题目内容
16.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1;则CO还原Fe2O3(s)的热化学方程式为( )
| A. | Fe2O3+3CO=2Fe+3CO2△H=-28.5kJ•mol-1( ) | |
| B. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ | |
| C. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=+28.5kJ•mol-1 | |
| D. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1. |
分析 依据热化学方程式和盖斯定律计算得到所需热化学方程式,第一个方程-第二个方程×3得到CO还原Fe2O3(s)的热化学方程式.
解答 解:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
故选D.
点评 本题主要考查了热化学方程式的书写,盖斯定律和计算应用是解题关键,题目较简单,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
6.下列叙述正确的是( )
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 物质燃烧不一定是放热反应 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
7.下列各组微粒中,质子数和电子数均相等的是( )
| A. | Na+和He | B. | H2O和D2O | C. | NH4+和NH3 | D. | H2SO4和H3PO4 |
11.有五个系列的同族元素的物质,101.3kPa时测定的沸点(℃)如表所示:
对应表中内容,下列叙述中不正确的是( )
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b)5.7 | I2184.0 |
| ③ | (c)19.4 | HCl-84.0 | HBr-67.0 | HI-35.5 |
| ④ | H2O100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | a、b、e的化学式分别为Ne、Br2、SnH4 | |
| B. | 系列②物质均有氧化性,系列③物质对应水溶液均是强酸 | |
| C. | 系列④中各化合物的稳定性顺序为:H2O>H2S>(d)>H2Te | |
| D. | 上表内的物质(c)和H2O,由于氢键的影响,其熔沸点在同族中特别高 |
8.下列各数值表示有关元素的原子序数,其中能以共价键相互结合形成稳定化合物的是( )
| A. | 8与11 | B. | 9与9 | C. | 2和19 | D. | 6与8 |
6.下列有关物质的表述中正确的是( )
| A. | 18O的原子结构示意图: | B. | 中子数为8的氮原子:${\;}_{8}^{15}$N | ||
| C. | 次氯酸的电子式: | D. | NH4+的结构式: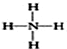 |