题目内容
自然界含有丰富的碘酸钠(NaIO3).工业上生产I2的方法之一就是用NaHSO4来还原碘酸钠,反应的第一步是用适量的NaHSO3将NaIO3还原为NaI,该反应的离子方程式为IO3-+3HSO3-→I-+3SO42-+3H+;第二步是在稀硫酸作用中,生产的碘化钠与NaIO3作用析出单质碘:5NaI+NaIO3+3H2SO4→3I2+3Na2SO4+□
(1)将第二步的化学反应方程式补充完整,并在下面的横线上标明电子转移的数目和方向.
(2)第二步反应中,还原过程为 → .(均填化学式)
(3)第二步反应中,氧化产物与还原产物之比为 .
(4)上述两步反应中共用去NaIO3和NaHSO3的物质的量的最简整数比是 .
(1)将第二步的化学反应方程式补充完整,并在下面的横线上标明电子转移的数目和方向.
(2)第二步反应中,还原过程为
(3)第二步反应中,氧化产物与还原产物之比为
(4)上述两步反应中共用去NaIO3和NaHSO3的物质的量的最简整数比是
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)5NaI+NaIO3+3H2SO4→3I2+3Na2SO4+□中,由原子守恒可知,还生成H2O,I元素的化合价由-1价升高为0,I元素化合价由+5价降低为0,该反应转移5e-;
(2)I元素的化合价降低被还原;
(3)氧化产物与还原产物均为碘,结合电子守恒分析;
(4)由两步反应可知,①IO3-+3HSO3-=I-+3SO42-+3H+、②5NaI+NaIO3+3H2SO4=3I2+3Na2SO4+3H2O,①×5+②存在6NaIO3~15NaHSO3,以此来解答.
(2)I元素的化合价降低被还原;
(3)氧化产物与还原产物均为碘,结合电子守恒分析;
(4)由两步反应可知,①IO3-+3HSO3-=I-+3SO42-+3H+、②5NaI+NaIO3+3H2SO4=3I2+3Na2SO4+3H2O,①×5+②存在6NaIO3~15NaHSO3,以此来解答.
解答:
解:(1)由原子守恒可知反应为5NaI+NaIO3+3H2SO4=3I2+3Na2SO4+3H2O,I元素的化合价由-1价升高为0,I元素化合价由+5价降低为0,该反应转移5e-,电子转移的数目和方向为 ,故答案为:
,故答案为: ;
;
(2)第二步反应中,还原过程为NaIO3→I2,故答案为:NaIO3;I2;
(3)第二步反应中,氧化产物与还原产物均为碘,I元素的化合价由-1价升高为0,I元素化合价由+5价降低为0,由原子守恒可知氧化产物与还原产物之比为5:1,
故答案为:5:1;
(4)由两步反应可知,①IO3-+3HSO3-=I-+3SO42-+3H+、②5NaI+NaIO3+3H2SO4=3I2+3Na2SO4+3H2O,①×5+②存在6NaIO3~15NaHSO3,共用去NaIO3和NaHSO3的物质的量的最简整数比是6:15=2:5,故答案为:2:5.
 ,故答案为:
,故答案为: ;
;(2)第二步反应中,还原过程为NaIO3→I2,故答案为:NaIO3;I2;
(3)第二步反应中,氧化产物与还原产物均为碘,I元素的化合价由-1价升高为0,I元素化合价由+5价降低为0,由原子守恒可知氧化产物与还原产物之比为5:1,
故答案为:5:1;
(4)由两步反应可知,①IO3-+3HSO3-=I-+3SO42-+3H+、②5NaI+NaIO3+3H2SO4=3I2+3Na2SO4+3H2O,①×5+②存在6NaIO3~15NaHSO3,共用去NaIO3和NaHSO3的物质的量的最简整数比是6:15=2:5,故答案为:2:5.
点评:本题考查氧化还原反应的计算,为高频考点,把握习题中的信息、元素的化合价变化、电子守恒和原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
同种元素形成的不同原子(或离子)一定具有相同的( )
| A、质量数 | B、质子数 |
| C、中子数 | D、核外电子数 |
25℃时,0.1mol?L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
| A、该溶液中由水电离出的c(H+)=1×10-3 mol?L-1 |
| B、由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
| D、0.1 mol?L-1HA溶液与0.05 mol?L-1NaOH溶液等体积混合后所得溶液中2c(H+)+c(HA)=c(A-)+2c(OH-) |
下列反应化学方程式正确的是( )
| A、CH3COOH+CH3CH2OH→CH3COOCH2CH3+H2O | ||
B、nCH3-CH=CH2
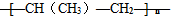 | ||
| C、CH3COO-+HCl→Cl-+CH3COOH | ||
| D、CO32-+CH3COOH→CH3COO-+CO2↑+H2O |
把质量分数为5.3%的Na2CO3溶液蒸发掉60g水,水溶液变为20ml,质量分数变为15.9%,没有晶体析出,则浓缩液中Na2CO3的物质的量浓度为( )
| A、0.9mol?L-1 |
| B、2.25mol?L-1 |
| C、1.50mol?L-1 |
下列各组金属混合物质量相同,它们分别跟足量盐酸反应,在相同状况下产生氢气的体积也相同,则其中锌的质量分数最高的是( )
| A、Zn和Al |
| B、Zn和Al |
| C、Zn和Mg |
| D、Zn和Na |
 将NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水.产生1.16g白色沉淀,再向所得溶液中逐渐加入1.00mol/L的盐酸,加入盐酸的体积和生成沉淀的关系如图所示:
将NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水.产生1.16g白色沉淀,再向所得溶液中逐渐加入1.00mol/L的盐酸,加入盐酸的体积和生成沉淀的关系如图所示: