题目内容
把质量分数为5.3%的Na2CO3溶液蒸发掉60g水,水溶液变为20ml,质量分数变为15.9%,没有晶体析出,则浓缩液中Na2CO3的物质的量浓度为( )
| A、0.9mol?L-1 |
| B、2.25mol?L-1 |
| C、1.50mol?L-1 |
考点:溶液中溶质的质量分数及相关计算
专题:计算题
分析:设浓缩后溶液的质量是xg,表示出原溶液的质量,由蒸发溶剂前后溶质的质量不变,据此列方程计算浓缩后溶液的质量,再计算碳酸钠的质量,根据n=
计算碳酸钠的物质的量,再根据c=
计算溶液物质的量浓度.
| m |
| M |
| n |
| V |
解答:
解:设浓缩后溶液的质量是xg,则原溶液的质量为(x+60)g,由蒸发溶剂前后溶质的质量不变,故:
(x+60)g×5.3%=xg×15.9%
解得x=30
故碳酸钠的物质的量为(30g×15.9%)÷106g/mol=0.045mol,
故浓缩后碳酸钠的物质的量浓度为
=2.25mol/L,
故选B.
(x+60)g×5.3%=xg×15.9%
解得x=30
故碳酸钠的物质的量为(30g×15.9%)÷106g/mol=0.045mol,
故浓缩后碳酸钠的物质的量浓度为
| 0.045mol |
| 0.02L |
故选B.
点评:本题考查溶液质量分数、物质的量浓度有关计算,比较基础,注意根据浓缩过程中碳酸钠的质量不变解答.

练习册系列答案
相关题目
在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体,在同温同压下,两容器内的气体一定相同的是( )
| A、原子数 | B、密度 |
| C、质量 | D、电子数 |
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )


| A、a为正极,b为负极;NaClO和NaCl |
| B、a为负极,b为正极;NaClO和NaCl |
| C、a为阳极,b为阴极;HClO和NaCl |
| D、a为阴极,b为阳极;HClO和NaCl |
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)═CO(g)+H2O(g)△H=a kJ?mol-1其化学平衡常数K和温度t的关系如下表:下列说法中正确的是( )
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、该反应的正反应为吸热反应,即a<0 |
| B、当v正(H2)=v正(H2O)时该反应达到化学平衡状态 |
| C、当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动 |
| D、当平衡浓度符合 c(CO2)?c(H2)=c(CO)?c(H2O)时的温度为830℃ |

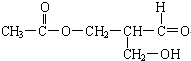 在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示.而且,该有机化合物具有光学活性.下列有机物是否具有光学活性?
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示.而且,该有机化合物具有光学活性.下列有机物是否具有光学活性?