题目内容
下列各组金属混合物质量相同,它们分别跟足量盐酸反应,在相同状况下产生氢气的体积也相同,则其中锌的质量分数最高的是( )
| A、Zn和Al |
| B、Zn和Al |
| C、Zn和Mg |
| D、Zn和Na |
考点:元素质量分数的计算
专题:计算题
分析:Zn+2HCl=ZnCl2 +H2↑
65g 2g
Al+2HCl=
AlCl3+H2↑
18g 2g
Mg+2HCl=MgCl2+H2↑
24g 2g
2Na+2HCl=2NaCl+H2↑,
46g 2g
由以上反应可知,生成等量的氢气,消耗的锌的质量最大,则等质量的金属,锌生成的氢气的量最少;Zn与其它金属组金属混合物,分别跟足量盐酸反应,在相同状况下产生氢气的体积相同,由于锌生成的氢气较少,则另一种金属生成氢气应该较多.
65g 2g
| 2 |
| 3 |
| 2 |
| 3 |
18g 2g
Mg+2HCl=MgCl2+H2↑
24g 2g
2Na+2HCl=2NaCl+H2↑,
46g 2g
由以上反应可知,生成等量的氢气,消耗的锌的质量最大,则等质量的金属,锌生成的氢气的量最少;Zn与其它金属组金属混合物,分别跟足量盐酸反应,在相同状况下产生氢气的体积相同,由于锌生成的氢气较少,则另一种金属生成氢气应该较多.
解答:
解:Zn+2HCl=ZnCl2 +H2↑
65g 2g
Al+2HCl=
AlCl3+H2↑
18g 2g
Mg+2HCl=MgCl2+H2↑
24g 2g
2Na+2HCl=2NaCl+H2↑,
46g 2g
由以上反应可知,生成等量的氢气,消耗的锌的质量最大,则等质量的金属,锌生成的氢气的量最少,铝生成的氢气最多;
Zn与其它金属组金属混合物,各组金属混合物质量相同,分别跟足量盐酸反应,在相同状况下产生氢气的体积相同,
质量相同时锌的含量越高,生成氢气越少,要求生成的氢气相同,则另一种金属生成的氢气较多,
已知等质量的金属,铝生成的氢气最多,所以Zn和Al在一起时,锌的质量分数最高;
故选B.
65g 2g
| 2 |
| 3 |
| 2 |
| 3 |
18g 2g
Mg+2HCl=MgCl2+H2↑
24g 2g
2Na+2HCl=2NaCl+H2↑,
46g 2g
由以上反应可知,生成等量的氢气,消耗的锌的质量最大,则等质量的金属,锌生成的氢气的量最少,铝生成的氢气最多;
Zn与其它金属组金属混合物,各组金属混合物质量相同,分别跟足量盐酸反应,在相同状况下产生氢气的体积相同,
质量相同时锌的含量越高,生成氢气越少,要求生成的氢气相同,则另一种金属生成的氢气较多,
已知等质量的金属,铝生成的氢气最多,所以Zn和Al在一起时,锌的质量分数最高;
故选B.
点评:本题考查了金属混合物与盐酸的反应,侧重于分析能力和基础知识的应用能力的考查,题目难度中等.

练习册系列答案
相关题目
下列微粒属于同位素的是( )
| A、H2和D2 |
| B、40K和40Ca |
| C、12C 和14C |
| D、O2和O3 |
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g)?2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )
| A、67% | B、50% |
| C、25% | D、5% |
下列说法正确的是(NA表示阿伏加德罗常数)( )
| A、常温常压下,1mol氮气含有NA个氮分子 |
| B、标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5NA个 |
| C、常温下,18g重水所含中子数为10NA个 |
| D、31g白磷分子中,含有的共价单键数目是NA个 |

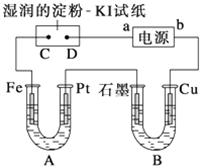 电解装置如图所示.图中B装置盛1L 2mol?L-1的Na2SO4溶液,A装置中盛1L 2mol?L-1AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:
电解装置如图所示.图中B装置盛1L 2mol?L-1的Na2SO4溶液,A装置中盛1L 2mol?L-1AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答: