题目内容
下列反应化学方程式正确的是( )
| A、CH3COOH+CH3CH2OH→CH3COOCH2CH3+H2O | ||
B、nCH3-CH=CH2
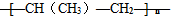 | ||
| C、CH3COO-+HCl→Cl-+CH3COOH | ||
| D、CO32-+CH3COOH→CH3COO-+CO2↑+H2O |
考点:化学方程式的书写
专题:
分析:A.酯化反应应在浓硫酸加热条件下进行;
B.丙烯加聚反应生成聚丙烯;
C.盐酸为强酸,应拆开;
D.电荷不守恒;
B.丙烯加聚反应生成聚丙烯;
C.盐酸为强酸,应拆开;
D.电荷不守恒;
解答:
解:A.酯化反应应在浓硫酸加热条件下进行,即CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故A错误;
B.丙烯加聚反应生成聚丙烯,故B正确;
C.盐酸为强酸,应拆开,正确的方程式为:CH3COO-+H+→CH3COOH,故C错误;
D.电荷不守恒,正确的方程式为:CO32-+2CH3COOH→2CH3COO-+CO2↑+H2O,故D错误.
故选B
| 浓硫酸 |
| △ |
B.丙烯加聚反应生成聚丙烯,故B正确;
C.盐酸为强酸,应拆开,正确的方程式为:CH3COO-+H+→CH3COOH,故C错误;
D.电荷不守恒,正确的方程式为:CO32-+2CH3COOH→2CH3COO-+CO2↑+H2O,故D错误.
故选B
点评:本题主要对方程式的书写条件及其离子方程式的书写进行判断,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
若
X表示X元素的一个原子,则该原子的( )
58 28 |
| A、核电荷数为30 |
| B、相对原子质量为58 |
| C、核内有30个中子 |
| D、核外有58个电子 |
下列说法正确的是(NA表示阿伏加德罗常数)( )
| A、常温常压下,1mol氮气含有NA个氮分子 |
| B、标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5NA个 |
| C、常温下,18g重水所含中子数为10NA个 |
| D、31g白磷分子中,含有的共价单键数目是NA个 |

