题目内容
6.已知H-H键能为436kJ/mol,H-N键能为391kJ/mol,N≡N键的键能为946kJ/mol,则反应:N2(g)+3H2(g)═2NH3(g)△H=?( )| A. | +46 kJ/mol | B. | +92kJ/mol | C. | -46 kJ/mol | D. | -92 kJ/mol |
分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据反应热=反应物的总键能-生成物的总键能计算N2(g)+3H2(g)═2NH3(g)的△H.
解答 解:已知:H-H键能为436kJ•mol-1,H-N键能为391kJ•mol-1,N≡N键的键能946kJ•mol-1,
反应N2(g)+3H2(g)=2NH3(g)的焓变△H=反应物的总键能-生成物的总键能=946kJ•mol-1+436kJ•mol-1×3-391kJ•mol-1×6=-92kJ•mol-1,
故选D.
点评 本题考查反应热的计算,题目难度不大,明确“焓变△H=反应物的总键能-生成物的总键能”为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
13.A、B、C、D均为短周期主族元素,原子序数依次增大,其质子的最外层电子数之和为18,A和C同主族,B原子的电子层数与最外层电子数相等,D元素最高正价与最低负价的绝对值之差为6.下列说法不正确的是( )
| A. | A的一种单质具有良好的导电性 | |
| B. | 氧化物对应水化物的酸性:D>A | |
| C. | B、C的单质均可与NaOH溶液反应生成氢气 | |
| D. | A、B、C三种元素均可以与D元素形成共价化合物 |
1.2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率.她成为首获科学类诺贝尔奖的中国人.青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯.下列有关说法正确的是( )


| A. | 青蒿素分子式为C15H2405 | |
| B. | 反应②原子利用率为100% | |
| C. | 该过程中青蒿素生成双氢青蒿素属于氧化反应 | |
| D. | 1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠 |
18.下列关于苯乙烯(结构简式为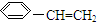 )的叙述错误的是( )
)的叙述错误的是( )
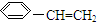 )的叙述错误的是( )
)的叙述错误的是( )| A. | 可以和溴水反应 | |
| B. | 分子中所有原子可能共面 | |
| C. | 是苯的同系物 | |
| D. | 1mol苯乙烯可以和4mol H2发生加成反应 |
15.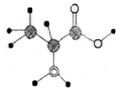 如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )
如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )
 如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )
如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )| A. | 分子式为C3H7O2N | |
| B. | 该分子不能与碳酸钠发生反应 | |
| C. | 该分子可以与盐酸发生反应 | |
| D. | 该分子在一定条件下可以反应生成高分子化合物 |
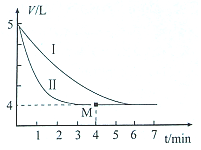 磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1
磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1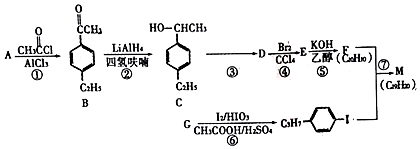
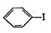 +H≡C-H→
+H≡C-H→ =C+H,回答下列问题:
=C+H,回答下列问题: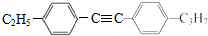 ,A的名称为乙苯.
,A的名称为乙苯. .
. 的合成路线:
的合成路线:
 .
. .
.