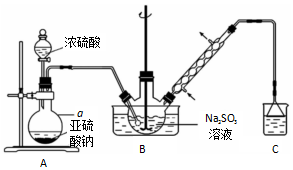
题目内容
15. 磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1
磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1(1)SO2Cl2中S的化合价是+6.
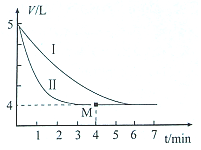
(2)恒温时,将SO2与Cl2各0.l mol充入体积可变的密闭容器中发生上述反应,容器体积变化如图曲线I所示.
①平衡时c( SO2Cl2)=0.01mol/L.
②仅改变某一条件,就能使容器体积变化为曲线II,这个条件是使用催化剂,当反应至M点时放出的热量为3.892kJ.
③不能(填“能”、“不能”)仅改变某一条件,使平衡常数K和反应速率v(正)都增大,理由是正反应为放热反应,要使K增大只能降温,而降低温度反应速率减小.
(3)测定磺酰氯纯度:称取0.3000g磺酰氯试样溶于28.00mL l.000mol/L NaOH溶液中,充分反应后,用1.000mol/L HCl返滴定至终点,耗用盐酸20.16mL.(杂质不参加反应)
①磺酰氯能发生剧烈水解反应生成两种强酸,化学方程式为SO2Cl2+2H2O=H2SO4+2HCl.
②该试样纯度为88.20%.
(4)Li-SO2Cl2新型电池的总反应为2Li+SO2Cl2═2LiCl+SO2,则正极反应为SO2Cl2+2e-=2Cl-+SO2↑.
分析 (1)SO2Cl2中Cl为-1价,O为-2价,化合物中正负化合价的倒数和为0;
(2)由图可知,5V气体达到平衡时变化为4L,体积之比等于物质的量之比,平衡时物质的量为0.2mol×$\frac{4}{5}$=0.16mol,
SO2(g)+Cl2(g)?SO2Cl2(g)
开始 0.1 0.1 0
转化 x x x
平衡 0.1-x 0.1-x x
则0.1-x+0.1-x+x=0.16mol,解得x=0.04mol,
①结合c=$\frac{n}{V}$计算;
②I与II始终态的量相同,II中反应速率快;物质的量与热量成正比;
③该反应为放热反应,K只与温度有关;
(3)①SO2Cl2遇水发生剧烈水解,根据水解原理可知为H-与Cl-结合生成HCl,-SO2-基团结合2个-OH生成H2SO4;
②结合SO2Cl2+2H2O=H2SO4+2HCl、H++OH-=H2O计算;
(4)正极是SO2Cl2中+6价的硫得电子发生还原反应,据此书写.
解答 解:(1)SO2Cl2中Cl为-1价,O为-2价,化合物中正负化合价的倒数和为0,则S元素的化合价为0-(-1)×2-(-2)×2=+6,故答案为:+6;
(2)由图可知,5V气体达到平衡时变化为4L,体积之比等于物质的量之比,平衡时物质的量为0.2mol×$\frac{4}{5}$=0.16mol,
SO2(g)+Cl2(g)?SO2Cl2(g)
开始 0.1 0.1 0
转化 x x x
平衡 0.1-x 0.1-x x
则0.1-x+0.1-x+x=0.16mol,解得x=0.04mol,
①平衡时c( SO2Cl2)=$\frac{0.04mol}{4L}$=0.01mol/L,故答案为:0.01mol/L;
②I与II始终态的量相同,II中反应速率快,改变条件为使用催化剂;物质的量与热量成正比,则当反应至M点时放出的热量为0.04mol×97.3kJ/mol=3.892kJ,
故答案为:使用催化剂;3.892kJ;
③该反应为放热反应,K只与温度有关,则不能仅改变某一条件,使平衡常数K和反应速率v(正)都增大,降低温度时反应速率减小、K增大,
故答案为:不能;正反应为放热反应,要使K增大只能降温,而降低温度反应速率减小;
(3)①SO2Cl2遇水发生剧烈水解,生成HCl和H2SO4,反应方程式为SO2Cl2+2H2O=H2SO4+2HCl,故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
②反应后,用1.000mol/L HCl返滴定至终点,耗用盐酸20.16mL,则中和的NaOH为0.02016L×1.000mol/L=0.02016mol,则中和磺酰氯需要的NaOH为0.028L×l.000mol/L-0.02016mol=0.00784mol,由SO2Cl2+2H2O=H2SO4+2HCl可知n(SO2Cl2)=$\frac{0.00784mol}{4}$=0.00196mol,其质量为0.00196mol×135g/mol=0.2642g,该试样纯度为$\frac{0.2642g}{0.3g}$×100%=88.20%,故答案为:88.20%;
(4)正极是SO2Cl2中+6价的硫得电子发生还原反应,可知电极反应式为SO2Cl2+2e-=2Cl-+SO2↑,故答案为:SO2Cl2+2e-=2Cl-+SO2↑.
点评 本题考查化学平衡的计算,为高频考点,把握图中体积变化与物质的量的变化的关系、平衡三段法计算、平衡移动、物质含量测定计算为解答的关键,侧重分析与计算能力的考查,综合性较强,题目难度中等.

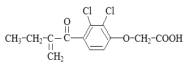 .下列有关利尿酸的说法中正确的是( )
.下列有关利尿酸的说法中正确的是( )| A. | 分子式是C13H14O4Cl2 | |
| B. | 1mol利尿酸最多能与5mol H2发生加成反应 | |
| C. | 一定条件下能发生加聚、缩聚反应 | |
| D. | 分子内处于同一平面内的原子不超过10个 |
| A. | 该反应是一个放热反应 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| C. | 该反应是一个吸热反应 | |
| D. | 参加反应的氢气和氧气的总能量高于反应生成的水的总能量 |
| A. | 烯烃、炔烃、苯环、醛和葡萄塘在一定条件下均可与H2发生加成反应 | |
| B. | 卤代烃的水解反应、酯的水解反应均为取代反应 | |
| C. | 乙醇发生的分子内脱水反应、分子间脱水反应均为消去反应 | |
| D. | 乙醇、乙烯均可在一定条件下发生氧化反应生成乙醛 |
 某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释.平衡时的pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释.平衡时的pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | 曲线Ⅱ对应氯化铵溶液 | |
| B. | 与等浓度的NaOH溶液恰好反应时曲线Ⅰ对应的溶液消耗NaOH溶液体积大 | |
| C. | b点比c点水的电离程度大 | |
| D. | c、d两点的离子积常数不等 |
| A. | NO中有少量的NO2:用水洗涤后再干燥 | |
| B. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| C. | O2中有少量的CO:通过灼热的氧化铜 | |
| D. | NO2中有少量NH3:用水洗涤后干燥 |
| A. | 25℃时,1 LpH=l的硫酸溶液中,含有H+的数目为0.2NA | |
| B. | 1 mol Na2O2与水完全反应时转移电子数目为2 NA | |
| C. | 向含1 mol Cl-的NH4Cl溶液中加入氨水使溶液呈中性,此时溶液中NH4+数目为NA | |
| D. | 向2 mL0.5 mol/L硅酸钠溶液中滴入过量盐酸制硅酸胶体,所得胶粒数目为0.001 NA |
| A. | +46 kJ/mol | B. | +92kJ/mol | C. | -46 kJ/mol | D. | -92 kJ/mol |