题目内容
12.能正确表示下列反应的离子方程式是( )| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
分析 A.硝酸具有强的氧化性,能够氧化二价铁子;
B.漏掉铵根离子与氢氧根离子的反应;
C.醋酸为弱电解质,保留化学式;
D.二者反应生成氢氧化铁和氯化镁.
解答 解:A.FeO与稀硝酸反应,离子方程式3FeO+10H++NO3-=3Fe3++NO↑+5H2O,故A错误;
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应,离子方程式:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O,故B错误;
C.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸,离子方程式:CO32-+CH3COOH═CH3COO-+HCO3-,故C错误;
D.向FeCl3溶液中加入Mg(OH)2,离子方程式:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分及反应的客观事实,题目难度不大.

练习册系列答案
相关题目
2.短周期元素甲、乙、丙、丁的原子序数依次增大,甲原子核外有三种能量不同的电子.乙、丙和丁的原子核外均有一个未成对电子.甲、乙、丙最高价氧化物对应的水化物两两之间能相互反应.下列说法错误的是( )
| A. | 元素丙的单质可用于冶炼金属 | B. | 丙与丁形成的化合物能升华 | ||
| C. | 甲与乙形成的化合物溶于水呈酸性 | D. | 简单离子半径:丁>乙>丙 |
3.(1)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则:
①该温度下,水的离子积常数Kw=10-13.
②该温度下,100mL 0.1mol/L的稀硫酸溶液中由水电离的c(OH-)=5×10-13mol/L.
(2)实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用NaOH溶液或Fe2(SO4)3溶液吸收多余的SO2气体.用Fe2(SO4)3溶液吸收多余的SO2气体,写出SO2与Fe2(SO4)3溶液反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
(3)用Fe2(SO4)3溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有H+、Fe2+、SO42-和极少量的OH-.某同学认为还可能存在其他离子,并提出假设进行实验探究.
①提出合理假设:
假设1:还存在HSO3-、SO32-;
假设2:还存在Fe3+;
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
①该温度下,水的离子积常数Kw=10-13.
②该温度下,100mL 0.1mol/L的稀硫酸溶液中由水电离的c(OH-)=5×10-13mol/L.
(2)实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用NaOH溶液或Fe2(SO4)3溶液吸收多余的SO2气体.用Fe2(SO4)3溶液吸收多余的SO2气体,写出SO2与Fe2(SO4)3溶液反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
(3)用Fe2(SO4)3溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有H+、Fe2+、SO42-和极少量的OH-.某同学认为还可能存在其他离子,并提出假设进行实验探究.
①提出合理假设:
假设1:还存在HSO3-、SO32-;
假设2:还存在Fe3+;
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,加稀硫酸酸化,然后再滴入几滴品红溶液; | 现象:品红不褪色 结论:假设1不成立; |
| 步骤2:另取少量吸收液于试管中, 滴入几滴KSCN溶液. | 现象:溶液变红 结论:假设2成立. |
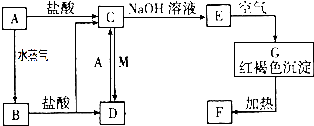
7.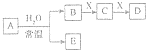 中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( )
中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( )
 中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( )
中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( )| A. | 若X是Na2SO3,C是能使品红溶液褪色的气体,则A可能是氯气,且D和E不反应 | |
| B. | 若A是单质,B和D的反应是OH-+HCO3-═H2O+CO32- 则E-定能还原CuO | |
| C. | 若B、X均为单质,D为CO,C能和E反应,则E为NaOH | |
| D. | 若D为白色沉淀,且与A的摩尔质量相等,则X一定是铝盐 |
4.用NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1molCu和足量热浓硫酸反应可生成SO3分子数为0.1NA | |
| B. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| C. | 常温常压下,6.0g SiO2含有的SiO2分子数为0.1NA | |
| D. | 工业上将氨气与氧气在催化剂作用下发生氧化反应,若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数NA可表示为:$\frac{22.4n}{5V}$ |