题目内容
2.碳、硅、锗(Ge)均属于碳族元素,碳族元素的化合物种类繁多.(1)碳能形成多种化合物分子,其中所含电子数最少的是CH4(填分子式),列举该物质的一个用途:化工原料(或燃料).
(2)某化合物的分子式为C5HxN,若分子中C、N原子最外层都达到8电子稳定结构,则x的最大值是13,此时该物质中C的质量分数为69%(结果保留2为有效数字).
(3)SiO2晶体是制作光导纤维的主要原料.
①玻璃中含有SiO2实验室中盛放烧碱溶液的试剂瓶不能用磨口玻璃塞,原因是SiO2+2OH-═SiO32-+H2O.(用离子方程式表示)
②SiO2可用于制备有机反应重要还原剂NaBH4,有挂反应如下,请配平
1Na2B4O7+16Na+7SiO2+8H2═4NaBH4+7Na2SiO3.
(4)锗也是重要的碳族元素,锗酸钠的组成比较复杂,为了测定某锗酸钠的组成,分别测定了该锗酸钠中钠和锗的质量分数分别为16.94%、53.68%,则该锗酸钠的化学式为Na2Ce2O5.将该锗酸钠加入足量的稀盐酸,可制得难溶于水的锗酸(H2CeO3),写出该反应的化学方程式:Na2Ce2O5+2HCl+H2O=2H2CeO3↓+2NaCl.
分析 (1)碳能形成多种化合物分子中所含电子数最少的是甲烷,甲烷是重要的化工原料;
(2)某化合物的分子式为C5HxN,若分子中C、N原子最外层都达到8电子稳定结构,依据烷烃的组成及多1个N原子增加1个H分析x的最大值,然后计算出此时C的质量分数;
(3)①根据二氧化硅能够与氢氧化钠溶液反应生成硅酸钠和水分析;
②根据氧化还原反应中得失电子数相等配平方程式;
(4)先计算出氧元素的质量分数,然后根据n=$\frac{m}{M}$计算出该锗酸钠中Na、Ge、O的个数之比,从而确定其化学式;结合反应物、生成物利用质量守恒配平该反应方程式.
解答 解:(1)碳能形成多种化合物分子,最简单的有机物为CH4,CH4分子中所含电子数最少;甲烷可以作燃料、化工原料等,
故答案为:CH4;化工原料(或燃料);
(2)某化合物的分子式为C5HxN,若分子中C、N原子最外层都达到8电子稳定结构,依据烷烃的组成可知5个C时最多含有12个H原子,增加1个N原子会增加1个H,所以x的最大值为:x=12+1=13,其分子式为:C5H13N,该分子中C的质量分数为:$\frac{12×5}{12×5+1×13+14}$×100%≈69%,
故答案为:13;69%;
(3)①因玻璃塞中的二氧化硅与氢氧化钠反应生成硅酸钠,具有粘合性,使试剂瓶在下次使用时不能打开,其离子反应为:SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
②该反应中,H元素的化合价由0价变为-1价,钠元素的化合价由0价变为+1价,1mol钠变为钠离子,失去1mol电子,1mol氢气得到2mol电子变为H-,再结合原子守恒配平方程式为:Na2B4O7+16Na+7SiO2+8H2=4NaBH4+7Na2SiO3,
故答案为:1;16;7;8;4;7;
(4)锗酸钠中钠和锗的质量分数分别为16.94%、53.68%,则氧元素的质量分数为:1-16.94%-53.68%=29.38%,则该锗酸钠中Na、Ge、O原子数目之比为:$\frac{16.94%}{23}$:$\frac{53.68%}{73}$:$\frac{29.38%}{16}$=2:2:5,该锗酸钠的化学式为:Na2Ce2O5;
将该锗酸钠加入足量的稀盐酸,可制得难溶于水的锗酸(H2CeO3),根据质量守恒定律配平可得:Na2Ce2O5+2HCl+H2O=2H2CeO3↓+2NaCl,
故答案为:Na2Ce2O5;Na2Ce2O5+2HCl+H2O=2H2CeO3↓+2NaCl.
点评 本题考查了碳族元素单质及其化合物性质,题目难度中等,涉及氧化还原反应配平、化学方程式书写、质量分数计算、化学式确定等知识,试题知识点较多、综合性较强,充分考查了学生的学生分析能力及灵活应用能力.

| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
| A. | 某溶液的pH=7,则该溶液为中性溶液 | |
| B. | 一定温度下,向AgCl饱和溶液中加入少量NaCl固体,Ksp(AgCl)减小 | |
| C. | 常温下,反应X(s)+Y(l)═2Z(g)不能自发,则该反应的△H>0 | |
| D. | 常温下,0.01mol/L的NaOH溶液中由水电离的c(H+)=1.0×10-2mol/L |
| A. | NaHCO3比Na2CO3热稳定性差 | |
| B. | NaHCO3比Na2CO3与稀盐酸反应的速度快 | |
| C. | 在相同温度下,Na2CO3的溶解度大于NaHCO3 | |
| D. | Na2CO3能使澄清石灰水变浑浊,而NaHCO3不行 |
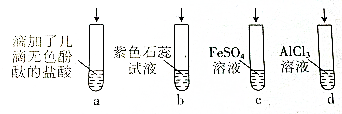
| A. | 若滴加过量的浓氨水,试管a中溶液由无色变红色 | |
| B. | 试管b中溶液由紫色变为蓝色 | |
| C. | 试管c中先有白色沉淀,后变为灰绿色,然后变为红褐色 | |
| D. | 试管d中先有白色沉淀,后白色沉淀消失 |
| A. | 3,3二甲基4乙基戊烷 | B. | 2,5,5三甲基己烷 | ||
| C. | 2,3二甲基丁烯 | D. | 3甲基1戊炔 |
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl 工业上利用该反应制备TiO2纳米粉 | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
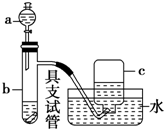 如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.
如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.