题目内容
2.短周期元素甲、乙、丙、丁的原子序数依次增大,甲原子核外有三种能量不同的电子.乙、丙和丁的原子核外均有一个未成对电子.甲、乙、丙最高价氧化物对应的水化物两两之间能相互反应.下列说法错误的是( )| A. | 元素丙的单质可用于冶炼金属 | B. | 丙与丁形成的化合物能升华 | ||
| C. | 甲与乙形成的化合物溶于水呈酸性 | D. | 简单离子半径:丁>乙>丙 |
分析 甲原子核外有三种能量不同的电子,则甲的核外电子有1s、2s、2p三种,甲位于第二周期;甲、乙、丙最高价氧化物对应的水化物两两之间能相互反应,说明甲、乙、丙最高价氧化物对应的水合物有酸、两性氢氧化物、强碱,甲位于第二周期,原子序数对应4,只能为N元素;乙和丙原子核外均有一个未成对电子,原子序数丙大于乙,则丙为Al元素、乙为Na元素;丁原子核外均有一个未成对电子,原子序数大于Al,则丁为Cl元素,据此进行解答.
解答 解:甲原子核外有三种能量不同的电子,则甲的核外电子有1s、2s、2p三种,甲位于第二周期;甲、乙、丙最高价氧化物对应的水化物两两之间能相互反应,说明甲、乙、丙最高价氧化物对应的水合物有酸、两性氢氧化物、强碱,甲位于第二周期,原子序数对应4,只能为N元素;乙和丙原子核外均有一个未成对电子,原子序数丙大于乙,则丙为Al元素、乙为Na元素;丁原子核外均有一个未成对电子,原子序数大于Al,则丁为Cl元素,
A.丙为铝,通过铝热反应可以冶炼金属,故A正确;
B.丙为Al、丁为Cl,二者形成的混合物为氯化铝,氯化铝加热到180℃升华,故B正确;
C.钠与N元素形成的混合物为叠氮化钠,叠氮化钠与水反应生成氢氧化钠和氨气,溶液呈碱性,故C错误;
D.乙、丙、丁形成的离子中,氯离子的电子层最多,则氯离子半径最大,钠离子嗯哼铝离子的电子层相同,核电荷数越大的离子半径越小,则离子半径丁>乙>丙,故D正确;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.水的电离平衡曲线如图所示,下列说法中,正确的( )
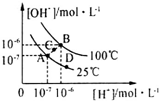

| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3•H2O)的值逐渐减小 | |
| C. | 在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | 100℃时,0.05mol•L-1 H2SO4溶液的pH≠1 |
10.关于Na2CO3和NaHCO3性质的说法正确的是( )
| A. | 等浓度时水溶液碱性:NaHCO3>Na2CO3 | |
| B. | 热稳定性:NaHCO3>Na2CO3 | |
| C. | 与盐酸溶液反应的速率(快慢):NaHCO3<Na2CO3 | |
| D. | 等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,NaHCO3产生的CO2多 |
17.下列变化不属于氧化还原反应的是( )
| A. | Na2SO3溶液在空气中变质 | B. | 工业上炼铁 | ||
| C. | 二氧化硫的漂白原理 | D. | 将氯气通入冷的消石灰浊液中 |
12.能正确表示下列反应的离子方程式是( )
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |