题目内容
4.足量铁粉与一定量的盐酸反应,为了减慢反应速率,但不减少氢气的产量,可加入下列物质中的( )| A. | 水 | B. | NaOH固体 | C. | Na2CO3固体 | D. | NaNO3溶液 |
分析 根据发生的反应为Fe+2H+═Fe2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,以此来解答.
解答 解:A.加入水,浓度降低,则减慢反应速率,但生成氢气的总量不变,故A正确;
B.加入NaOH,发生酸碱中和反应,减少氢气的生成,故B错误;
C.加入Na2CO3固体,与盐酸反应生成二氧化碳,减少了氢气的生成,故C错误;
D.加入硝酸钠,不生成氢气,故D错误.
故选A.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、原电池对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 可用加热氯化铵分解的方法制取氨气 | |
| C. | 在BaCl2溶液中通入SO2气体会产生白色沉淀 | |
| D. | 向某无色溶液中加入AgNO3溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则该无色溶液中可能含有Cl- |
15.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO说法正确的是( )
| A. | 电离程度:HCN>HClO | |
| B. | pH:HClO>HCN | |
| C. | 酸根离子浓度:c(CN-)<c(ClO-) | |
| D. | 与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
12.下列关于氯的说法正确的是( )
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 35Cl、37Cl为不同的核素,有不同的化学性质 | |
| C. | 实验室制备Cl2,不宜用排水法收集 | |
| D. | 铁丝在氯气燃烧生成氯化亚铁 |
9.汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题.
(1)已知:N2(g)+O2(g)═2NO(g)△H1
N2(g)+3H2(g)?2NH3(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=3△H3-2△H1-2△H2(用含△H1、△H2、△H3的式子表达)
(2)汽车尾气中的CO、NOx都需要除去,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知该反应在任何温度下都不能自发进行,因此该设想便不能实现.由此判断该反应的△H大于0
目前,在汽车尾气系统中装置催化转化器可以减少CO、NO的污染,其化学反应方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(3)可用活性炭还原法处理氮氧化物.有关反应的化学方程式为:C(s)+2NO(g)?N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
则,30min后,改变某一条件,平衡发生了移动,则改变的条件是减少CO2浓度;若升高温度,NO浓度将减小(填“增大”、“不变”或“减小”).
(1)已知:N2(g)+O2(g)═2NO(g)△H1
N2(g)+3H2(g)?2NH3(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=3△H3-2△H1-2△H2(用含△H1、△H2、△H3的式子表达)
(2)汽车尾气中的CO、NOx都需要除去,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知该反应在任何温度下都不能自发进行,因此该设想便不能实现.由此判断该反应的△H大于0
目前,在汽车尾气系统中装置催化转化器可以减少CO、NO的污染,其化学反应方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(3)可用活性炭还原法处理氮氧化物.有关反应的化学方程式为:C(s)+2NO(g)?N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
16.下列有关说法正确的是( )
| A. | 普通锌锰干电池中的MnO2在工作时起催化作用 | |
| B. | lmol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| C. | 室温下,体积、pH均相同的HA和HB两种一元酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | 恒温恒压密闭容器中反应N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1达到平衡时,向容器中再充入一定量NH3,重新达平衡时a值减小 |
13.归纳是学习化学的一种常用方法,某同学归纳的物质及其所属类別与右图的对应关系正确的是( )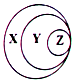

| A. | X-胶体 Y-混合物 Z-淀粉溶液 | B. | X-化合物 Y-含氧酸盐 Z-氯化钠 | ||
| C. | X-气态氢化物 Y-酸 Z-盐酸 | D. | X-强电解质 Y-强酸 Z-硫酸 |

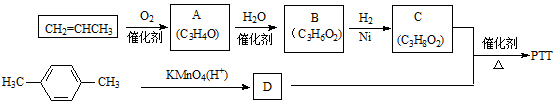

 ,反应类型为
,反应类型为