题目内容
6.用浓盐酸、浓硫酸、浓硝酸填空(1)具有强氧化性的酸是浓硫酸和浓硝酸
(2)能与浓硝酸混合生成王水的是浓盐酸
(3)能使蔗糖脱水炭化的物质是浓硫酸.
分析 (1)浓硫酸和浓硝酸具有强氧化性;
(2)王水的是浓硝酸和盐酸的混合物;
(3)浓硫酸具有脱水性,能使蔗糖脱水炭化;
解答 解:(1)浓硫酸和浓硝酸具有强氧化性,所以具有强氧化性的酸是浓硫酸和浓硝酸,故答案为:浓硝酸;
(2)王水的是浓硝酸和盐酸的混合物,所以能与浓硝酸混合生成王水的是浓盐酸,故答案为:浓盐酸;
(3)浓硫酸具有脱水性,能使蔗糖脱水炭化,故答案为:浓硫酸.
点评 本题考查了三大强酸的性质,其中浓硫酸能和部分金属发生钝化现象,浓硫酸和木炭反应时需要加热,浓硫酸具有吸水性,所以常作干燥剂,而能使蔗糖脱水炭化是浓硫酸的脱水性.

练习册系列答案
相关题目
17.化学与科学、技术、社会、环境密切相关,下列叙述正确的是( )
| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
17.下列说法中正确的是( )
| A. | 熵减的吸热反应可能是自发反应 | |
| B. | 需要加热的化学反应,生成物的总能量一定高于反应物的总能量 | |
| C. | 使用催化剂既不会改变反应的限度又不会改变反应的焓变 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
14.下列说法正确的是( )
| A. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 可用加热氯化铵分解的方法制取氨气 | |
| C. | 在BaCl2溶液中通入SO2气体会产生白色沉淀 | |
| D. | 向某无色溶液中加入AgNO3溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则该无色溶液中可能含有Cl- |
11.用水稀释0.1mol•L-1氨水时,溶液中随着水量的增加而减小的是( )
| A. | $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | OH-的物质的量 | ||
| C. | c(H+)×c(OH-) | D. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$、 |
18. 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.2}{{t}_{1}}$mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=0.32 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
15.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO说法正确的是( )
| A. | 电离程度:HCN>HClO | |
| B. | pH:HClO>HCN | |
| C. | 酸根离子浓度:c(CN-)<c(ClO-) | |
| D. | 与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
16.下列有关说法正确的是( )
| A. | 普通锌锰干电池中的MnO2在工作时起催化作用 | |
| B. | lmol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| C. | 室温下,体积、pH均相同的HA和HB两种一元酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | 恒温恒压密闭容器中反应N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1达到平衡时,向容器中再充入一定量NH3,重新达平衡时a值减小 |
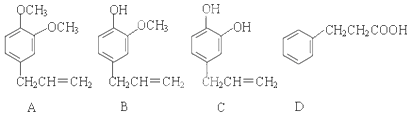

 ;
; .
.