题目内容
5.已知:Ⅰ、高温下铁跟水蒸气可以发生反应:3Fe+4H2O(g)=Fe3O4+4H2
Ⅱ、Fe3O4可以溶解在稀盐酸中:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O(在稀硫酸中也发生类似反应)
某化学小组在一次实验中,先将一定量的铁跟水蒸气反应,再将反应后得到的固体A溶于适量的稀硫酸中,使两者恰好完全反应得到溶液B.经过测定,溶液B里金属离子与硫酸根离子物质的量之比为4:5.
回答下列问题:
(1)溶液B中溶质的化学式为:FeSO4、Fe2(SO4)3.
(2)固体A的成分一定含有(写化学式)Fe、Fe3O4,形成溶液B时除了发生类似类似反应Ⅱ的反应外,还可能发生的反应有(用两个离子方程式表示):
①Fe+2H+=Fe2++H2↑,②2Fe3++Fe=3Fe2+.
(3)关于在同一溶液中,反应①和②进行的先后顺序,各位同学有不同观点:甲认为①先于②;乙认为②先于①;丙认为….
请就其中两种假设的情况进行讨论分析:
如果只发生①未发生②,则固体A中各成分的物质的量之比应为:1:1.
如果只发生②未发生①,则固体A中各成分的物质的量之比应为:1:5.
分析 (1)因固体A与稀硫酸恰好完全反应,所得溶液中阳离子只能是Fe2+与Fe3+两者中一种或两种,若全部是FeSO4,则金属离子与硫酸根离子之比为1:1,若全部为
Fe2(SO4)3,结合金属离子与硫酸根离子之比为2:3进行判断;
(2)根据反应Fe3O4+8H2SO4=FeSO4+Fe2(SO4)3+4H2O可知,若只有Fe3O4,Fe2+与Fe3+两者之比为1:2,金属离子与硫酸根离子的物质的量之比为3:8,则A中含有Fe3O4、Fe;两种固体均能与稀硫酸反应,并且生成的Fe3+也能与Fe发生反应,据此写出反应的离子方程式;
(3)设溶液B里Fe2+物质的量为x,则Fe3+的物质的量为4-x,硫酸根离子的物质的量为5,则根据电荷守恒可得:2x+3(4-x)=5×2,解得:x=2,则y=4-2=2,说明反应后溶液中Fe2+与Fe3+的物质的量之比为1:1,然后通过讨论判断固体A中Fe与Fe3O4的物质的量之比.
解答 解:(1)因固体A与稀硫酸恰好完全反应,所得溶液中阳离子只能是Fe2+与Fe3+两者中一种或两种,若全部是FeSO4,则金属离子与硫酸根离子之比为1:1,若全部为
Fe2(SO4)3,则金属离子与硫酸根离子之比为2:3,而溶液中金属离子与硫酸根离子之比为4:5,该比值大于2:3小于1:1,则溶液中含有Fe2+与Fe3+两种离子,即溶液B中溶质的化学式为:FeSO4、Fe2(SO4)3,
故答案为:FeSO4、Fe2(SO4)3;
(2)因为Fe3O4+8H2SO4=FeSO4+Fe2(SO4)3+4H2O,若只有Fe3O4,Fe2+与Fe3+两者之比为1:2,则A中除含有外Fe3O4,还含有Fe,即A中含有Fe3O4、Fe;
两种固体均能与稀硫酸反应,并且生成的Fe3+也能与Fe发生反应,则反应的离子方程式有:①Fe+2H+=Fe2++H2↑,②2Fe3++Fe=3Fe2+,
故答案为:Fe、Fe3O4;Fe+2H+=Fe2++H2↑;2Fe3++Fe=3Fe2+;
(3)设溶液B里Fe2+物质的量为x,则Fe3+的物质的量为4-x,硫酸根离子的物质的量为5,
则根据电荷守恒可得:2x+3(4-x)=5×2,解得:x=2,则y=4-2=2,说明反应后溶液中Fe2+与Fe3+的物质的量之比为1:1,
如果只发生①未发生②,Fe3O4中Fe2+与Fe3+两者之比为1:2,若要满足反应后溶液中Fe2+与Fe3+的物质的量之比为1:1,则Fe、Fe3O4的物质的量之比为1:1;
如果只发生②未发生①,设Fe的物质的量为xmol、Fe3O4的物质的量为ymol,ymolFe3O4中含有ymolFe2+、2ymolFe3+,xmolFe发生反应2Fe3++Fe=3Fe2+消耗2xmolFe3+,同时生成3xmolFe2+,则反应后溶液中含有(y+3x)molFe2+、(2y-2x)mol Fe3+,由于反应后溶液中Fe2+与Fe3+的物质的量之比为1:1,则(y+3x)=(2y-2x),整理可得:x:y=1:5,即Fe与Fe3O4的物质的量之比为1:5,
故答案为:1:1,1:5.
点评 本题考查了铁及其化合物性质,题目难度中等,明确常见元素及其化合物性质为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析、理解能力及逻辑推理能力.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| A. | 熵减的吸热反应可能是自发反应 | |
| B. | 需要加热的化学反应,生成物的总能量一定高于反应物的总能量 | |
| C. | 使用催化剂既不会改变反应的限度又不会改变反应的焓变 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
| A. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 可用加热氯化铵分解的方法制取氨气 | |
| C. | 在BaCl2溶液中通入SO2气体会产生白色沉淀 | |
| D. | 向某无色溶液中加入AgNO3溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则该无色溶液中可能含有Cl- |
| A. | 电离程度:HCN>HClO | |
| B. | pH:HClO>HCN | |
| C. | 酸根离子浓度:c(CN-)<c(ClO-) | |
| D. | 与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
 用图中的简易装置可以进行气体的发生和收集.
用图中的简易装置可以进行气体的发生和收集.
 ;.
;.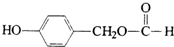 ;H:
;H: .
.