��Ŀ����
11�������������ȡ��ϩ��Ӧ��CH3-CH3��g��?CH2=CH2��g��+H2��g������1��������Ӧ��ƽ�ⳣ������ʽΪ$\frac{c��{H}_{2}��c��C{H}_{2}=C{H}_{2}��}{c��C{H}_{3}C{H}_{3}��}$
��2��������������˵��һ���¶���������Ӧ�ڐa���������Ѵ�ƽ�����bd��
a����λʱ��������Amol��ϩͬʱ����Amol����
b�������и���������ʵ�������ʱ����仯
c�������������ܶȲ���ʱ����仯
d������������ѹǿ����ʱ����仯
��3����֪��
| ���ۼ� | C-C | C=C | C-H | H-H |
| ����/KJ•mol-1 | 348 | 610 | 413 | 436 |
�����¶ȣ�ƽ�ⳣ��K���������������С�����䡱����
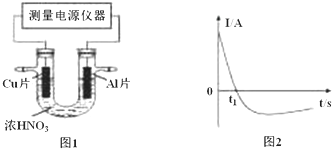
��4������������Ӧ��ͼ1�ܣ����ܡ����ܡ�����ʾ������Ũ�����¶ȵĹ�ϵ���������¶�Խ�ߣ���Ӧ����Խ��ƽ��ʱ��Խ�̣�������б��Խ���÷�Ӧ�����ȷ�Ӧ���¶�Խ�ߣ���ƽ��ʱ������Ũ��Խ��ͼ2���ܡ��ܡ����ܡ�����ʾ��Ӧ������ѹǿ�Ĺ�ϵ�������Ǹ÷�Ӧ������������ӵķ�Ӧ����ƽ����ټ�ѹ��ƽ�����淽���ƶ���V����V����
��5��һ���¶��£���nĦ���������V���ܱ������н��д����⣬ά������������䣬��������ƽ��ת����Ϊa������¶��·�Ӧ��ƽ�ⳣ��K=$\frac{{a}^{2}n}{V��1-a��}$���ú�n��V��a�Ĵ���ʽ��ʾ����
���� ��1��ƽ�ⳣ������������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻���
��2����ѧ��Ӧ�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٷ����仯���ɴ�������һЩ�������������仯���Դ˽����жϣ�
��3����Ӧ��=��Ӧ���ܼ���-���������ܼ��ܣ����л���Ľṹ��֪��Ӧ��CH3CH3���ܼ�����CH2=CH2��H2�ܼ���֮�
��4��ͼ1�����ȹ���ƽ�¶ȸߣ�ƽ��������У�������Ũ������ͼ2����ѹǿ��Ӧ��������ƽ��������У�����Ӧ���ʴ����淴Ӧ���ʣ�
��5��ƽ�ⳣ��K=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$��
��� �⣺��1�������������ȡ��ϩ��Ӧ��CH3-CH3��g��?CH2=CH2��g��+H2��g����ƽ�ⳣ��K=$\frac{c��{H}_{2}��c��C{H}_{2}=C{H}_{2}��}{c��C{H}_{3}C{H}_{3}��}$��
�ʴ�Ϊ��$\frac{c��{H}_{2}��c��C{H}_{2}=C{H}_{2}��}{c��C{H}_{3}C{H}_{3}��}$��
��2��CH3-CH3��g��?CH2=CH2��g��+H2��g����
a����λʱ��������Amol��ϩͬʱ����Amol������ֻ��˵����Ӧ������У�����˵����Ӧ�ﵽƽ��״̬����a����
b�������и���������ʵ�������ʱ����仯������Ũ�Ȳ��䣬˵�����淴Ӧ������ͬ����b��ȷ��
c�������������ܶȲ��䣬�����������ܶ�ʼ�ղ���ʱ����仯������˵����Ӧ�ﵽƽ��״̬����c����
d����Ӧǰ���������ʵ��������仯������������ѹǿ����ʱ����仯��˵����Ӧ�ﵽƽ��״̬����d��ȷ��
�ʴ�Ϊ��bd��
��3��CH3-CH3��g��?CH2=CH2��g��+H2��g������Ӧ��=��Ӧ���ܼ���-���������ܼ���=436KJ/mol+610KJ/mol+4��413KJ/mol-348KJ/mol-6��413KJ/mol=+128KJ/mol����Ӧ�ʱ����0������ӦΪ���ȷ�Ӧ������ƽ��������У�ƽ�ⳣ������
�ʴ�Ϊ��+128������
��4��ͼ1�����ȹ���ƽ�¶ȸߣ�ƽ��������У�������Ũ������ͼ1�ܱ�ʾ������Ũ�����¶ȵĹ�ϵ���¶�Խ�ߣ���Ӧ����Խ��ƽ��ʱ��Խ�̣�������б��Խ���÷�Ӧ�����ȷ�Ӧ���¶�Խ�ߣ���ƽ��ʱ������Ũ��Խ��ͼ2���ܱ�ʾ��Ӧ������ѹǿ�Ĺ�ϵ���÷�Ӧ������������ӵķ�Ӧ����ƽ����ټ�ѹ��ƽ�����淽���ƶ���V����V��������ѹǿ��Ӧ��������ƽ��������У�ͼ2������Ӧ���ʴ����淴Ӧ���ʴ���
�ʴ�Ϊ���ܣ��¶�Խ�ߣ���Ӧ����Խ��ƽ��ʱ��Խ�̣�������б��Խ���÷�Ӧ�����ȷ�Ӧ���¶�Խ�ߣ���ƽ��ʱ������Ũ��Խ���ܣ��÷�Ӧ������������ӵķ�Ӧ����ƽ����ټ�ѹ��ƽ�����淽���ƶ���V����V����
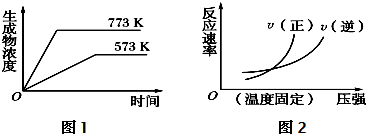
��5��һ���¶��£���nĦ���������V���ܱ������н��д����⣬ά������������䣬��������ƽ��ת����Ϊa������ƽ��������ʽ���㣬
CH3-CH3��g��?CH2=CH2��g��+H2��g����
��ʼ����mol/L�� $\frac{n}{V}$ 0 0
�仯����mol/L�� $\frac{n}{V}$a $\frac{n}{V}$a $\frac{n}{V}$a
ƽ������mol/L�� $\frac{n}{V}$��1-a�� $\frac{n}{V}$a $\frac{n}{V}$a
����¶��·�Ӧ��ƽ�ⳣ��K=$\frac{\frac{n}{V}a��\frac{n}{V}a}{\frac{n}{V}��1-a��}$=$\frac{{a}^{2}n}{V��1-a��}$��
�ʴ�Ϊ��$\frac{{a}^{2}n}{V��1-a��}$��
���� ���⿼���˻�ѧƽ��Ӱ�����ء���ѧƽ�ⳣ�����㡢ͼ�����Ӧ�ã�����ƽ���ƶ�ԭ���ͷ�Ӧ�����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�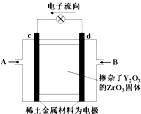 ��ͼ��ʾ����ϡ���������������Ե缫���������Ϸֱ�ͨ�����������������Ϊ������Y2O3��ZrO3���壬���ڸ������ܴ���O2-������˵����ȷ���ǣ�������
��ͼ��ʾ����ϡ���������������Ե缫���������Ϸֱ�ͨ�����������������Ϊ������Y2O3��ZrO3���壬���ڸ������ܴ���O2-������˵����ȷ���ǣ�������| A�� | c�缫����Ϊ����������AΪ���� | |
| B�� | d�缫�Ϸ�����Ӧ��CH4-8e-+4O2-�TCO2+2H2O | |
| C�� | O2-��c�缫�ƶ� | |
| D�� | �ô�װ������Դ��⾫��ͭ��d�缫���ͭ���� |
�����Ҵ���Ũ�����ȥ���������е���������
�ڽ�Cl2���Ʊ�������ʵ�����Ͻ��У��Լ���ʵ���еĿ�����Ⱦ
����ʳ�ͳ���ʯ��ˮ��֤�����к���̼����
������ˮ����ʯ�����Ƿ�����ϩ��
| A�� | �٢ڢ� | B�� | �٢ۢ� | C�� | �ڢۢ� | D�� | �٢ڢ� |
��1������Na2S2O3���������Ʊ���Һ������ͼ��ʾ�������У�����Ҫ�õ���������AB������ĸ������ȱ�ٵIJ����������ձ��������������������ƣ���
��2�����ݼ���������ƽ��ȡNa2S2O3�����������15.8g����ʵ����������������ȷ��������ƿ������ˮϴ�Ӻ�δ�����������ҺŨ��=���������������=������ͬ��0.2000mol•L-1������δ����Һ��ȴ�Ͷ����ˣ���������ҺŨ�ȣ�0.2000mol•L-1��
��3���õζ����궨�ľ��巽������ȡ20.00mL NaClO��Һ����ƿ�У���������ϡ���������KI���壬��0.2000mol•L -1 Na2S2O3����Һ�ζ����յ㣨������Һ��ָʾ�������Ĵ�ƽ��ʵ��ⶨ��V��Na2S2O3���������£�
����֪��I2+2Na2S2O3�T2NaI+Na2S4O6��
| �ⶨ���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
| V��Na2S2O3��/mL | 21.90 | 18.80 | 22.10 | 22.00 |
��NaClO��Һ�����ʵ���Ũ����0.1060mol/L��
 ijģ�⡰�˹���Ҷ���绯ѧʵ��װ����ͼ��ʾ����װ���ܽ�H2O��CO2ת��ΪO2��ȼ�ϣ�C3H8O��������˵����ȷ���ǣ�������
ijģ�⡰�˹���Ҷ���绯ѧʵ��װ����ͼ��ʾ����װ���ܽ�H2O��CO2ת��ΪO2��ȼ�ϣ�C3H8O��������˵����ȷ���ǣ�������| A�� | ��װ�ý���ѧ��ת��Ϊ���ܺ͵��� | |
| B�� | ��װ�ù���ʱ��H+��b������a����Ǩ�� | |
| C�� | ÿ����3mol O2����44.8LCO2����ԭ | |
| D�� | a�缫�ķ�ӦΪ��3CO2+16H+-18e-=C3H8O+4H2O |
��C��s��+H2O��g��?CO��g��+H2��g������CO��g��+H2O��g��?CO2��g��+H2��g��
����Ӧ�ﵽƽ��ʱ��c��H2��=1.9mol•L-1��c��CO��=0.1mol•L-1��������������ȷ���У�������
| A�� | CO��ƽ��ʱת����Ϊ10% | |
| B�� | ƽ��Ũ��c��CO2��=c��H2�� | |
| C�� | ƽ��ʱ����ƽ����Է�������ԼΪ23.3 | |
| D�� | ������������ʱ����С�����H2O��g����ת������֮���� |