题目内容
3.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=aKJ•mol-1CO(g)+H2O(g)═CO2(g)+H2(g)△H2=bKJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=cKJ•mol-1
则反应2CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=(a+2b-2c)KJ•mol-1.
分析 利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的;根据目标方程改写分方程,然后求出反应热.
解答 解:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=aKJ•mol-1 ①CO(g)+H2O(g)═CO2(g)+H2(g)△H2=bKJ•mol-1 ②2CO(g)+O2(g)═2CO2(g)△H3=cKJ•mol-1 ③反应2CO2(g)+CH4(g)═2CO(g)+2H2(g)为①+②×2-③×2得到,故此反应的△H=(a+2b-2c)kJ/mol,
故答案为:(a+2b-2c).
点评 本题考查了盖斯定律在计算中的应用,题目难度不大,注意把握分方程式与目标方程式的关系,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
11.乙烷催化脱氢制取乙烯反应:CH3-CH3(g)?CH2=CH2(g)+H2(g).
(1)上述反应的平衡常数表达式为$\frac{c({H}_{2})c(C{H}_{2}=C{H}_{2})}{c(C{H}_{3}C{H}_{3})}$
(2)下列描述中能说明一定温度下上述反应在恆容容器中已达平衡的是bd.
a.单位时间内生成Amol乙烯同时生成Amol氢气
b.容器中各气体的物质的量不随时间而变化
c.容器中气体密度不随时间而变化
d.容器中气体压强不随时间而变化
(3)已知:
计算上述反应的△H=+128KJ•mol-1.
升高温度,平衡常数K将增大(填“增大”、“减小”或“不变”).
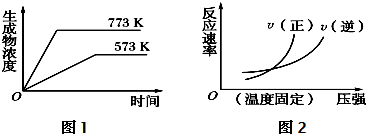
(4)对于上述反应,图1能(“能”或“不能”)表示生成物浓度与温度的关系,理由是温度越高,反应速率越大,达平衡时间越短(或曲线斜率越大);该反应是吸热反应,温度越高,达平衡时生成物浓度越大.图2不能“能”或“不能”)表示反应速率与压强的关系,理由是该反应是气体体积增加的反应,达平衡后再加压,平衡向逆方向移动,V逆>V正.
(5)一定温度下,将n摩尔乙烷放入V升密闭容器中进行催化脱氢,维持容器体积不变,测得乙烷的平衡转化率为a,则该温度下反应的平衡常数K=$\frac{{a}^{2}n}{V(1-a)}$(用含n、V、a的代数式表示).
(1)上述反应的平衡常数表达式为$\frac{c({H}_{2})c(C{H}_{2}=C{H}_{2})}{c(C{H}_{3}C{H}_{3})}$
(2)下列描述中能说明一定温度下上述反应在恆容容器中已达平衡的是bd.
a.单位时间内生成Amol乙烯同时生成Amol氢气
b.容器中各气体的物质的量不随时间而变化
c.容器中气体密度不随时间而变化
d.容器中气体压强不随时间而变化
(3)已知:
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 610 | 413 | 436 |
升高温度,平衡常数K将增大(填“增大”、“减小”或“不变”).
(4)对于上述反应,图1能(“能”或“不能”)表示生成物浓度与温度的关系,理由是温度越高,反应速率越大,达平衡时间越短(或曲线斜率越大);该反应是吸热反应,温度越高,达平衡时生成物浓度越大.图2不能“能”或“不能”)表示反应速率与压强的关系,理由是该反应是气体体积增加的反应,达平衡后再加压,平衡向逆方向移动,V逆>V正.

(5)一定温度下,将n摩尔乙烷放入V升密闭容器中进行催化脱氢,维持容器体积不变,测得乙烷的平衡转化率为a,则该温度下反应的平衡常数K=$\frac{{a}^{2}n}{V(1-a)}$(用含n、V、a的代数式表示).
18. 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
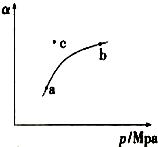
(1)某温度下,测得SO2(g)的平衡转化率(α)与体系总压强( p )的关系如上图所示.a、b两点对应的平衡常数K(a)= K(b) (填“>”“<”或“=”,下同)SO3浓度c(a)<c(b) c点,反应速率υ(正)<υ(逆).
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
①实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为$\frac{1.2}{t}$mol•L-1•min-1 ,②温度T1大于T2的理由是反应放热,温度升高,平衡向左移动,反应物转化率低.
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0(1)某温度下,测得SO2(g)的平衡转化率(α)与体系总压强( p )的关系如上图所示.a、b两点对应的平衡常数K(a)= K(b) (填“>”“<”或“=”,下同)SO3浓度c(a)<c(b) c点,反应速率υ(正)<υ(逆).
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
8.1mol过氧化钠与2mol碳酸氢钾固体混合后,在密闭容器中加热至250℃充分反应,排出气体物质后冷却,残留的固体物质和排出的气体分别是( )
| 残留的固体 | 排放的气体 | |
| A | Na2CO3 | O2、CO2和H2O(g) |
| B | K2CO3 、Na2CO3 | O2和H2O(g) |
| C | NaOH、K2CO3 | O2和CO2 |
| D | Na2O2、NaOH、Na2CO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
12.将下表中各组的两电极用导线相连后放入盛有对应该组的溶液中,能产生电流的是( )
| 序号 | 电极1 | 电极2 | 溶液 |
| A | Cu | Cu | 稀H2SO4 |
| B | Ag | Zn | 稀H2SO4 |
| C | Cu | Cu | 酒精 |
| D | C | C | ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |