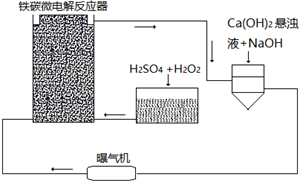
题目内容
20.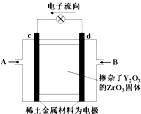 如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )
如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )| A. | c电极名称为负极,气体A为空气 | |
| B. | d电极上发生反应:CH4-8e-+4O2-═CO2+2H2O | |
| C. | O2-向c电极移动 | |
| D. | 用此装置作电源电解精炼铜,d电极与粗铜相连 |
分析 由电子流向可知,d为负极、c为正极,负极发生氧化反应,正极发生还原反应,则B为甲烷、A为空气,正极上氧气获得电子生成O2-,通过掺杂了Y2O3的ZrO3固体移向负极,甲烷在负极失去电子与O2-结合生成二氧化碳与水.电解精炼铜时,粗铜作阳极,连接电源的正极,纯铜作阴极,连接电源的负极.
解答 解:由电子流向可知,d为负极、c为正极,负极发生氧化反应,正极发生还原反应,则B为甲烷、A为空气,正极上氧气获得电子生成O2-,通过掺杂了Y2O3的ZrO3固体移向负极,甲烷在负极失去电子.
A.c为原电池的正极,故A错误;
B.d为负极,发生氧化反应,甲烷在负极失去电子与O2-结合生成二氧化碳与水,电极反应式为:CH4-8e-+4O2-═CO2+2H2O,故B正确;
C.原电池中阴离子移向负极,O2-向d电极移动,故C错误;
D.电解精炼铜时,粗铜作阳极,连接电源的c电极,纯铜作阴极,连接电源的d电极,故D错误,
故选:B.
点评 本题考查电解原理及其应用,关键是根据电子流向判断电极,再结合氧化还原反应与电极反应式分析解答,理解掌握电解工作原理与电极判断方法.

练习册系列答案
相关题目
13.某元素R的最高正价与最低负价的代数和为0,由此可以判断( )
| A. | R原子核外一定有4个电子层 | |
| B. | R原子最外层电子数一定为4 | |
| C. | R的气态氧化物比电子层数相同的其他非金属元素的气态氢化物稳定 | |
| D. | R元素气态氢化物的化学式为H2R |
8. “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
(1)下列措施中,有利于降低大气中CO2浓度的有abc (填字母).
A.采用节能技术,减少化石燃料的用量
B.鼓励乘坐公交车出行,倡导低碳生活
C.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△Hl=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(l)+3O2(g)△H2=+1366.8kJ/mol
则由乙烯水化制乙醇的热化学方程式是C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol.
(3)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
根据上表中数据分析:
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率增大(填“增大”“减小”或“不变”).
②该反应的正反应为放 (填“吸”或“放”)热反应.
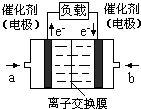
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是氧气(填“乙醇”或“氧气”),a处发生的电极反应是CH3CH2OH+16OH--12e-═2CO32-+11H2O.
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.(1)下列措施中,有利于降低大气中CO2浓度的有abc (填字母).
A.采用节能技术,减少化石燃料的用量
B.鼓励乘坐公交车出行,倡导低碳生活
C.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△Hl=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(l)+3O2(g)△H2=+1366.8kJ/mol
则由乙烯水化制乙醇的热化学方程式是C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol.
(3)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率增大(填“增大”“减小”或“不变”).
②该反应的正反应为放 (填“吸”或“放”)热反应.
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是氧气(填“乙醇”或“氧气”),a处发生的电极反应是CH3CH2OH+16OH--12e-═2CO32-+11H2O.
11.乙烷催化脱氢制取乙烯反应:CH3-CH3(g)?CH2=CH2(g)+H2(g).
(1)上述反应的平衡常数表达式为$\frac{c({H}_{2})c(C{H}_{2}=C{H}_{2})}{c(C{H}_{3}C{H}_{3})}$
(2)下列描述中能说明一定温度下上述反应在恆容容器中已达平衡的是bd.
a.单位时间内生成Amol乙烯同时生成Amol氢气
b.容器中各气体的物质的量不随时间而变化
c.容器中气体密度不随时间而变化
d.容器中气体压强不随时间而变化
(3)已知:
计算上述反应的△H=+128KJ•mol-1.
升高温度,平衡常数K将增大(填“增大”、“减小”或“不变”).
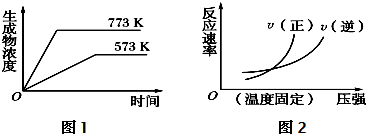
(4)对于上述反应,图1能(“能”或“不能”)表示生成物浓度与温度的关系,理由是温度越高,反应速率越大,达平衡时间越短(或曲线斜率越大);该反应是吸热反应,温度越高,达平衡时生成物浓度越大.图2不能“能”或“不能”)表示反应速率与压强的关系,理由是该反应是气体体积增加的反应,达平衡后再加压,平衡向逆方向移动,V逆>V正.
(5)一定温度下,将n摩尔乙烷放入V升密闭容器中进行催化脱氢,维持容器体积不变,测得乙烷的平衡转化率为a,则该温度下反应的平衡常数K=$\frac{{a}^{2}n}{V(1-a)}$(用含n、V、a的代数式表示).
(1)上述反应的平衡常数表达式为$\frac{c({H}_{2})c(C{H}_{2}=C{H}_{2})}{c(C{H}_{3}C{H}_{3})}$
(2)下列描述中能说明一定温度下上述反应在恆容容器中已达平衡的是bd.
a.单位时间内生成Amol乙烯同时生成Amol氢气
b.容器中各气体的物质的量不随时间而变化
c.容器中气体密度不随时间而变化
d.容器中气体压强不随时间而变化
(3)已知:
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 610 | 413 | 436 |
升高温度,平衡常数K将增大(填“增大”、“减小”或“不变”).
(4)对于上述反应,图1能(“能”或“不能”)表示生成物浓度与温度的关系,理由是温度越高,反应速率越大,达平衡时间越短(或曲线斜率越大);该反应是吸热反应,温度越高,达平衡时生成物浓度越大.图2不能“能”或“不能”)表示反应速率与压强的关系,理由是该反应是气体体积增加的反应,达平衡后再加压,平衡向逆方向移动,V逆>V正.

(5)一定温度下,将n摩尔乙烷放入V升密闭容器中进行催化脱氢,维持容器体积不变,测得乙烷的平衡转化率为a,则该温度下反应的平衡常数K=$\frac{{a}^{2}n}{V(1-a)}$(用含n、V、a的代数式表示).
8.1mol过氧化钠与2mol碳酸氢钾固体混合后,在密闭容器中加热至250℃充分反应,排出气体物质后冷却,残留的固体物质和排出的气体分别是( )
| 残留的固体 | 排放的气体 | |
| A | Na2CO3 | O2、CO2和H2O(g) |
| B | K2CO3 、Na2CO3 | O2和H2O(g) |
| C | NaOH、K2CO3 | O2和CO2 |
| D | Na2O2、NaOH、Na2CO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
 之比
之比
 Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定
Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定