题目内容
1.某温度下,C和H2O(g)在密闭容器里发生下列反应:①C(s)+H2O(g)?CO(g)+H2(g),②CO(g)+H2O(g)?CO2(g)+H2(g)
当反应达到平衡时,c(H2)=1.9mol•L-1,c(CO)=0.1mol•L-1.则下列叙述正确的有( )
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 平衡时气体平均相对分子质量约为23.3 | |
| D. | 其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
分析 氢气来源C与水的反应,CO与水的反应,二氧化碳来源与CO与水的反应,平衡时CO为C与水反应生成CO减去CO与水反应消耗的CO,令碳与水反应生成的氢气的浓度为amol/L,则生成的CO为amol/L,令CO与水反应生成氢气的浓度为bmol/L,则生成的二氧化碳的浓度为bmol/L,消耗的CO浓度为bmol/L,结合氢气、CO浓度计算.
解答 解:令碳与水反应生成的氢气的浓度为amol/L,则生成的CO为amol/L,令CO与水反应生成氢气的浓度为bmol/L,则生成的二氧化碳的浓度为bmol/L,消耗的CO浓度为bmol/L,
平衡时氢气的浓度为1.9mol/L,则amol/L+bmol/L=1.9mol/L,
平衡时CO的浓度为0.1mol/L,则amol/L-bmol/L=0.1mol/L,
联立解得a=1,b=0.9,
A、CO在平衡时转化率=$\frac{0.9mol}{1mol}$×100%=90%,故A错误;
B、故CO2的浓度为0.9mol/L,c(H2)=1.9mol•L-1,所以c(CO2)≠c(H2),故B错误;
C、平衡时时气体为c(H2)=1.9mol•L-1,c(CO)=0.1mol•L-1,CO2的浓度为0.9mol/L,H2O(g)的起始浓度不知你计算平衡水的浓度,不能计算平均摩尔质量,故C错误;
D、其他条件不变时,缩小体积,压强增大,C(s)+H2O(g)?CO(g)+H2(g)平衡逆向进行,CO(g)+H2O(g)?CO2(g)+H2(g)平衡不动,所以H2O(g)的转化率随之降低,故D正确;
故选D.
点评 本题考查化学平衡的有关计算,难度中等,清楚反应过程是关键.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
11.乙烷催化脱氢制取乙烯反应:CH3-CH3(g)?CH2=CH2(g)+H2(g).
(1)上述反应的平衡常数表达式为$\frac{c({H}_{2})c(C{H}_{2}=C{H}_{2})}{c(C{H}_{3}C{H}_{3})}$
(2)下列描述中能说明一定温度下上述反应在恆容容器中已达平衡的是bd.
a.单位时间内生成Amol乙烯同时生成Amol氢气
b.容器中各气体的物质的量不随时间而变化
c.容器中气体密度不随时间而变化
d.容器中气体压强不随时间而变化
(3)已知:
计算上述反应的△H=+128KJ•mol-1.
升高温度,平衡常数K将增大(填“增大”、“减小”或“不变”).
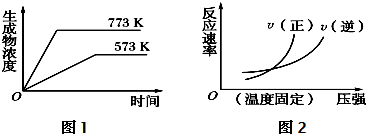
(4)对于上述反应,图1能(“能”或“不能”)表示生成物浓度与温度的关系,理由是温度越高,反应速率越大,达平衡时间越短(或曲线斜率越大);该反应是吸热反应,温度越高,达平衡时生成物浓度越大.图2不能“能”或“不能”)表示反应速率与压强的关系,理由是该反应是气体体积增加的反应,达平衡后再加压,平衡向逆方向移动,V逆>V正.
(5)一定温度下,将n摩尔乙烷放入V升密闭容器中进行催化脱氢,维持容器体积不变,测得乙烷的平衡转化率为a,则该温度下反应的平衡常数K=$\frac{{a}^{2}n}{V(1-a)}$(用含n、V、a的代数式表示).
(1)上述反应的平衡常数表达式为$\frac{c({H}_{2})c(C{H}_{2}=C{H}_{2})}{c(C{H}_{3}C{H}_{3})}$
(2)下列描述中能说明一定温度下上述反应在恆容容器中已达平衡的是bd.
a.单位时间内生成Amol乙烯同时生成Amol氢气
b.容器中各气体的物质的量不随时间而变化
c.容器中气体密度不随时间而变化
d.容器中气体压强不随时间而变化
(3)已知:
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 610 | 413 | 436 |
升高温度,平衡常数K将增大(填“增大”、“减小”或“不变”).
(4)对于上述反应,图1能(“能”或“不能”)表示生成物浓度与温度的关系,理由是温度越高,反应速率越大,达平衡时间越短(或曲线斜率越大);该反应是吸热反应,温度越高,达平衡时生成物浓度越大.图2不能“能”或“不能”)表示反应速率与压强的关系,理由是该反应是气体体积增加的反应,达平衡后再加压,平衡向逆方向移动,V逆>V正.

(5)一定温度下,将n摩尔乙烷放入V升密闭容器中进行催化脱氢,维持容器体积不变,测得乙烷的平衡转化率为a,则该温度下反应的平衡常数K=$\frac{{a}^{2}n}{V(1-a)}$(用含n、V、a的代数式表示).
12.将下表中各组的两电极用导线相连后放入盛有对应该组的溶液中,能产生电流的是( )
| 序号 | 电极1 | 电极2 | 溶液 |
| A | Cu | Cu | 稀H2SO4 |
| B | Ag | Zn | 稀H2SO4 |
| C | Cu | Cu | 酒精 |
| D | C | C | ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
16.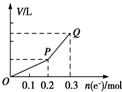 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A. | 0.1mol CuO | B. | 0.1 mol CuCO3 | ||
| C. | 0.1mol Cu(OH)2 | D. | 0.05 mol Cu2(OH)2CO3 |
6.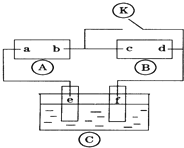 图中
图中 为直流电,
为直流电, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀池.接通电路后发现
为电镀池.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )
 图中
图中 为直流电,
为直流电,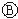 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀池.接通电路后发现
为电镀池.接通电路后发现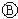 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通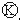 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | b为直流电的正极 | B. | e电极为铁 | ||
| C. | f极发生还原反应 | D. | d极发生的反应为:2H++2e-=H2↑ |
8.下列金属中,遇到盐酸和氢氧化钠溶液都能放出气体的是( )
| A. | Cu | B. | Mg | C. | Fe | D. | Al |
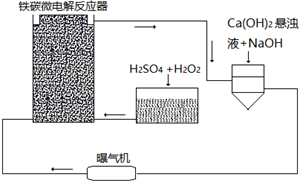
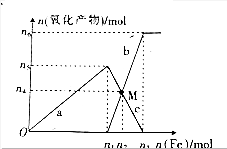 与加入铁粉的物质的量的关系如图所示.
与加入铁粉的物质的量的关系如图所示.