题目内容
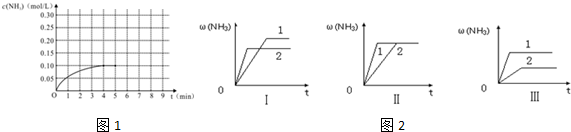
16.实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是AB(填字母),还缺少的玻璃仪器是烧杯、玻璃杯(填仪器名称).
(2)根据计算需用天平称取Na2S2O3固体的质量是15.8g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度=(填“>”“<”或“=”,下同)0.2000mol•L-1.若还未等溶液冷却就定容了,则所得溶液浓度>0.2000mol•L-1.
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000mol•L -1 Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
②NaClO溶液的物质的量浓度是0.1060mol/L.
分析 (1)用Na2S2O3固体来配制标准溶液,不需要圆底烧瓶、分液漏斗;溶解Na2S2O3固体,还需要烧杯、玻璃棒;
(2)实验室没有450mL的容量瓶,应选用500mL的容量瓶,需要Na2S2O3固体,n=0.2000mol/L×0.5L=1.000mol,m=1.000mol×158g/mol=15.8g;定容时,还需要向容量瓶中加入蒸馏水,若容量瓶用蒸馏水洗涤后未干燥,不会产生误差;未等溶液冷却就定容了,冷却后,溶液体积减小,所得溶液浓度偏大;
(3)①NaClO溶液中加入适量稀盐酸和足量KI固体时发生氧化还原反应,其离子方程式为ClO-+2I-+2H+═Cl-+I2+H2O;
②先求四次平行实验测定的平均V(Na2S2O3),
设NaClO溶液的浓度是x.由ClO-+2I-+2H+═Cl-+I2+H2O、I2+2Na2S2O3═2NaI+Na2S4O6
找到关系式:NaClO~2Na2S4O6
1 2
20mL×c 0.2000mol/L×21.20mL
解之得:c=0.1060mol/L.
解答 解:(1)用Na2S2O3固体来配制标准溶液,不需要圆底烧瓶、分液漏斗;溶解Na2S2O3固体,还需要烧杯、玻璃棒;
故答案为:AB;烧杯、玻璃棒;
(2)配制0.2000mol•L -1Na2S2O3标准溶液450mL,实验室没有450mL的容量瓶,应选用500mL的容量瓶,需要Na2S2O3固体,n=0.2000mol/L×0.5L=1.000mol,m=1.000mol×158g/mol=15.8g;定容时,还需要向容量瓶中加入蒸馏水,若容量瓶用蒸馏水洗涤后未干燥,不会产生误差;未等溶液冷却就定容了,冷却后,溶液体积减小,所得溶液浓度偏大;
故答案为:15.8;=;>;
(3)①NaClO溶液中加入适量稀盐酸和足量KI固体时发生氧化还原反应,其离子方程式为ClO-+2I-+2H+═Cl-+I2+H2O;
故答案为:ClO-+2I-+2H+═Cl-+I2+H2O;
②四次平行实验测定的平均体积为:V(Na2S2O3)=$\frac{21.90mL+18.80mL+22.10mL+22.00mL}{4}$=21.20mL,
设NaClO溶液的浓度是x,根据反应ClO-+2I-+2H+═Cl-+I2+H2O、I2+2Na2S2O3═2NaI+Na2S4O6
可得关系式:NaClO~2Na2S4O6
1 2
20mL×c 0.2000mol/L×21.20mL
解得:c=0.1060mol/L,
故答案为:0.1060 mol/L.
点评 本题考查溶液的配制、误差分析、关系式计算等知识,题目难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案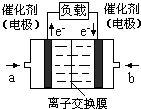 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.(1)下列措施中,有利于降低大气中CO2浓度的有abc (填字母).
A.采用节能技术,减少化石燃料的用量
B.鼓励乘坐公交车出行,倡导低碳生活
C.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△Hl=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(l)+3O2(g)△H2=+1366.8kJ/mol
则由乙烯水化制乙醇的热化学方程式是C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol.
(3)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率增大(填“增大”“减小”或“不变”).
②该反应的正反应为放 (填“吸”或“放”)热反应.
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是氧气(填“乙醇”或“氧气”),a处发生的电极反应是CH3CH2OH+16OH--12e-═2CO32-+11H2O.
(1)上述反应的平衡常数表达式为$\frac{c({H}_{2})c(C{H}_{2}=C{H}_{2})}{c(C{H}_{3}C{H}_{3})}$
(2)下列描述中能说明一定温度下上述反应在恆容容器中已达平衡的是bd.
a.单位时间内生成Amol乙烯同时生成Amol氢气
b.容器中各气体的物质的量不随时间而变化
c.容器中气体密度不随时间而变化
d.容器中气体压强不随时间而变化
(3)已知:
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 610 | 413 | 436 |
升高温度,平衡常数K将增大(填“增大”、“减小”或“不变”).
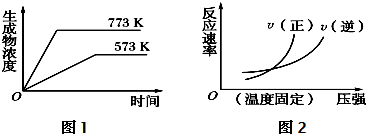
(4)对于上述反应,图1能(“能”或“不能”)表示生成物浓度与温度的关系,理由是温度越高,反应速率越大,达平衡时间越短(或曲线斜率越大);该反应是吸热反应,温度越高,达平衡时生成物浓度越大.图2不能“能”或“不能”)表示反应速率与压强的关系,理由是该反应是气体体积增加的反应,达平衡后再加压,平衡向逆方向移动,V逆>V正.
(5)一定温度下,将n摩尔乙烷放入V升密闭容器中进行催化脱氢,维持容器体积不变,测得乙烷的平衡转化率为a,则该温度下反应的平衡常数K=$\frac{{a}^{2}n}{V(1-a)}$(用含n、V、a的代数式表示).
| 残留的固体 | 排放的气体 | |
| A | Na2CO3 | O2、CO2和H2O(g) |
| B | K2CO3 、Na2CO3 | O2和H2O(g) |
| C | NaOH、K2CO3 | O2和CO2 |
| D | Na2O2、NaOH、Na2CO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | v (O2)=0.0125 mol•(L•s)-1 | B. | v (NO)=0.01mol•(L•s)-1 | ||
| C. | v (H2O)=0.12 mol•(L•s)-1 | D. | v(NH3)=0.1 mol•(L•s)-1 |
 图中
图中 为直流电,
为直流电, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀池.接通电路后发现
为电镀池.接通电路后发现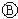 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | b为直流电的正极 | B. | e电极为铁 | ||
| C. | f极发生还原反应 | D. | d极发生的反应为:2H++2e-=H2↑ |
 Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定
Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定