题目内容
15. “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:(1)钠、钾着火,下列可用来灭火的是D.
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,可能发生氧化还原反应,下列反应可能发生的是A、B、D、F.
A.NH4NO3→N2+O2+H2O
B.NH4NO3→NH3+HNO3
C.NH4NO3→O2+HNO3+H2O
D.NH4NO3→N2+HNO3+H2O
E.NH4NO3→N2+NH3+H2O
F.NH4NO3→N2O+H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法
①H2O2处理法:NaCN+H2O2--N2↑+X+H2O,推测X的化学式为NaHCO3,双氧水的电子式为
 .
.②NaClO处理法:aCN-+bClO-+2cOH-═dCNO-+eN2↑+fCO32-+bCl-+cH2O. 方程式中e:f的值为
B(填选项标号).
A.1 B.$\frac{1}{2}$ C.2 D.不能确定
③用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,则电解过程中,阳极的电极反应式为Cl-+2OH--2e-═ClO-+H2O.
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等.取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol•L-1)进行实验.
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为80%.
分析 (1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧;
(2)氧化还原反应中有化合价升高的元素也有化合价降低的元素;
(3)①根据元素守恒确定X中元素,根据转移电子守恒、原子守恒确定X化学式;双氧水属于共价化合物,双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2;
③阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水;
(4)①根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,根据氧化还原反应配平;
②干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2),原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,据此计算.
解答 解:(1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧,所以应该采用细沙灭火,
故答案为:D;
(2)氧化还原反应中有化合价升高的元素也有化合价降低的元素,
A.NH4NO3→N2+O2+H2O中N元素化合价降低、O元素化合价升高,符合氧化还原反应,故A选;
B.NH4NO3→NH3+HNO3中各元素化合价不变,符合复分解反应条件,故B选;
C.NH4NO3→O2+HNO3+H2O中只有O元素化合价升高,所以不符合氧化还原反应,故C不选;
D.NH4NO3→N2+HNO3+H2O中N元素有化合价升高的也有化合价降低的,符合氧化还原反应,故D选;
E.NH4NO3→N2+NH3+H2O中只有N元素化合价降低,所以不符合氧化还原反应,故E不选;
F.NH4NO3→N2O+H2O中N元素有化合价升高的也有化合价降低的,符合氧化还原反应,故F选;
故答案为:A、B、D、F;
(3)①根据元素守恒知,X中含有Na、C元素,该反应中N元素化合价由-3价转化为0价、NaCN中C元素化合价为+2价,则C元素化合价由+2价转化为+4价,转移电子数为6,根据转移电子守恒、原子守恒知X为NaHCO3,双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ;
;
故答案为:NaHCO3; ;
;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,以因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2,所以e:f=1:2,
故答案为:B;
③阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O;
故答案为:Cl-+2OH--2e-═ClO-+H2O;
(4)①根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
②干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,物质的量为$\frac{1.408g}{44g/mol}$=0.032mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,所以该实验中测得CN-被处理的百分率为$\frac{0.032mol}{0.04mol}$×100%=80%,
故答案为:80%.
点评 本题考查氧化还原反应的计算及含量测定、电解原理的应用等,题目综合性较强,注重高频考点的考查,侧重分析与计算能力的考查,注意反应中元素的化合价变化,题目难度中等.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案| A. | 13C与15N具有相同的中子数 | |
| B. | 0.012kg 13C所含的碳原子数为阿伏加德罗常数 | |
| C. | 等物质的量的13C17O和15N2,两气体具有相同的质子数、原子数和质量 | |
| D. | 13C、15N和C60、N70互为同位素 |
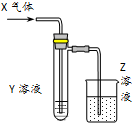 用以如图示装置研究物质的性质,能够获得可靠结论的是( )
用以如图示装置研究物质的性质,能够获得可靠结论的是( )| X | Y | Z | 结论 | |
| A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
| B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
| C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
| D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 先加入BaCl2溶液,再加入足量的HCl溶液,产生了白色沉淀.溶液中一定含有大量的SO42- | |
| B. | 加入足量的CaCl2溶液,产生了白色沉淀.溶液中一定含有大量的CO32- | |
| C. | 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体.溶液中一定含有大量的NH4+ | |
| D. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- |
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA | |
| B. | 1L0.1 mol•L-1 Na2CO3溶液中含有CO32-数为0.1 NA | |
| C. | 常温常压下,18g水含有的分子数为 NA | |
| D. | 常温下,1mol Cl2与过量NaOH溶液反应,转移电子总数为2NA |
①CO、O2(2:1)②NH3、O2(8:1)③NO2、O2(4:1)④N2、H2(1:3)
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol?1,下列判断正确的是ad.
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)?C(s)+H2O(1)△H=-QkJ•mol?1,则Q<131.4
d.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol?1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
①0min~2min 内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad.(填字母)
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过).

①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为4H++O2+4e-=2H2O.
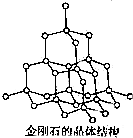 CH4、NH3、H20和HF均为含10e-的分子.
CH4、NH3、H20和HF均为含10e-的分子.