题目内容
7.写出下列反应的离子方程式:(1)实验室制备二氧化碳气体CaCO3+2H+=Ca2++CO2↑+H2O
(2)氢氧化钡与稀硫酸反应Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓
(3)食盐水与硝酸银溶液反应Ag++Cl-=AgCl↓
(4)氢氧化钠溶液与硝酸的反应H++OH-=H2O.
分析 (1)实验室中用碳酸钙与盐酸反应制取二氧化碳气体;
(2)稀硫酸与氢氧化钡反应生成硫酸钡沉淀和水;
(3)氯化钠与硝酸银溶液反应生成氯化银沉淀和硝酸钠;
(4)氢氧化钠和硝酸都是强电解质,二者发生中和反应生成水.
解答 解:(1)实验室中用碳酸钙与盐酸反应制取二氧化碳,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(2)氢氧化钡与稀硫酸反应的离子方程式为:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓,
故答案为:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓;
(3)氯化钠与硝酸银溶液反应的实质为银离子与氯离子反应生成氯化银沉淀,反应的离子方程式为:Ag++Cl-=AgCl↓,
故答案为:Ag++Cl-=AgCl↓;
(4)稀硝酸与氢氧化钠溶液反应生成硝酸钠和水,反应的离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O.
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,如:难溶物、弱电解质等需要保留化学式,必须符合守恒关系(如:质量守恒和电荷守恒等)等,试题培养了学生的灵活应用能力.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
5.下列选项实验操作、现象、结论都正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 加热蒸干TiCl4溶液 | 产生大量固体 | 固体成分为TiCl4 |
| B | 用双氧水滴定KI淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
| C | 将K3[Fe(CN)6]溶液滴加到某溶液中 | 产生蓝色沉淀 | 该溶液中含有Fe2+ |
| D | 将SO2通入石蕊溶液中 | 溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
18.2SO2(g)+O2(g)═2SO3(g)△H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是( )
| A. | 甲和乙中反应的化学平衡常数相同 | |
| B. | 乙和丙中的二氧化硫的生成速率相同 | |
| C. | 乙中SO3的体积分数大于丙 | |
| D. | 转化率:α甲(SO2)+α乙(SO3)<1 |
2.下列化学用语正确的是( )
| A. | 氯化钠的电子式: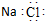 | |
| B. | 苯的结构简式:C6H6 | |
| C. | 硅的原子结构示意图: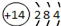 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
12.网传云南曲靖市越州镇约5000余吨的重毒化工废料铬渣被非法丢放,毒水被直接排放到南盘江中.
I.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是C13+,其次是Fe3+、Al3+、Ca2+、Mg2+):
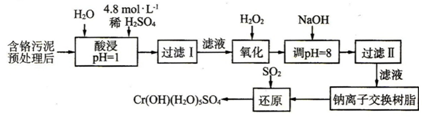
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)实验室用18.4mol/L浓硫酸配制250mL 4.8mol/L硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需250mL容量瓶、胶头滴管.
(2)加入H202的作用是氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离.调节溶液的pH=8 是为了除去Fe3+和Al3+离子.
(3)还原过程发生以下反应,请配平:
1Na2Cr2O7+3S02+11H2O═2Cr(OH)(H20)5S04+1Na2S04
(4)钠离子交换树脂的原理为Mn++nNaR═MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+.
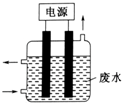
Ⅱ.工业废水中常含有一定量的Cr2O72-和Cr042-,它们会对人类及生态系统产生很大损害,必须进行处理.其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.阳极的电极反应式为Fe-2e-=Fe2+.在阴极附近溶液pH升高的原因是2H++2e-=H2 ↑(用电极反应方程式解释).产生的阳极产物在处理废水中铬元素时所起的作用是做还原剂,将+6价的Cr还原为+3价的Cr.
I.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是C13+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | ─ | ─ | 4.7 | ─ |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)加入H202的作用是氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离.调节溶液的pH=8 是为了除去Fe3+和Al3+离子.
(3)还原过程发生以下反应,请配平:
1Na2Cr2O7+3S02+11H2O═2Cr(OH)(H20)5S04+1Na2S04
(4)钠离子交换树脂的原理为Mn++nNaR═MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+.
Ⅱ.工业废水中常含有一定量的Cr2O72-和Cr042-,它们会对人类及生态系统产生很大损害,必须进行处理.其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.阳极的电极反应式为Fe-2e-=Fe2+.在阴极附近溶液pH升高的原因是2H++2e-=H2 ↑(用电极反应方程式解释).产生的阳极产物在处理废水中铬元素时所起的作用是做还原剂,将+6价的Cr还原为+3价的Cr.
17.2,2,4三甲基戊烷的一氯取代物的同分异构体有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: .
. 钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用.
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用. 其含有的共价键类型是极性共价键.
其含有的共价键类型是极性共价键.