题目内容
3.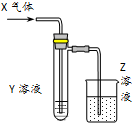 用以如图示装置研究物质的性质,能够获得可靠结论的是( )
用以如图示装置研究物质的性质,能够获得可靠结论的是( )| X | Y | Z | 结论 | |
| A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
| B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
| C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
| D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.甲醛和新制氢氧化铜的反应,新制氢氧化铜为碱性溶液,反应需要加热才能观察到红色沉淀;
B.CH3Cl中是氯原子,不能和硝酸银溶液发生反应;
C.二氧化硫和高锰酸钾溶液的反应是利用二氧化硫的还原性,二氧化硫被高锰酸钾溶液氧化为硫酸溶液褪色,剩余二氧化硫被氢氧化钠溶液吸收;
D.氯气通过淀粉碘化钾溶液发生氧化还原反应,氯气氧化碘离子为碘单质,碘单质遇到淀粉变蓝色,剩余氯气被氢氧化钠溶液吸收.
解答 解:A.新制氢氧化铜为碱性溶液,反应需要加热才能观察到红色沉淀,装置图无加热装置,反应不能进行,不能验证甲醛的还原性,故A错误;
B.应是一氯甲烷先水解得到氯离子后,加酸再加入硝酸银溶液检验氯元素的存在,CH3Cl中是氯原子,不能和硝酸银溶液发生反应,不能验证一氯甲烷含氯元素,故B错误;
C.二氧化硫和高锰酸钾溶液的反应是利用二氧化硫的还原性,二氧化硫还原高锰酸钾溶液褪色,剩余二氧化硫被氢氧化钠溶液吸收防止污染环境,不能验证二氧化硫的漂白性,故C错误;
D.氯气通过淀粉碘化钾溶液发生氧化还原反应,氯气氧化碘离子为碘单质,Cl2+2I-=I2+2Cl-,碘单质遇到淀粉变蓝色,证明了氯气具有氧化性,剩余氯气被氢氧化钠溶液吸收防止污染空气,能验证氯气的强氧化性,故D正确;
故选D.
点评 本题考查了气体的性质和实验检验方法,注意实验条件的掌握,题目难度中等.

练习册系列答案
相关题目
1.下列物质中,导电性最差的是( )
| A. | 熔融氢氧化钠 | B. | 石墨棒 | C. | 盐酸溶液 | D. | 固态氢氧化钾 |
18.2SO2(g)+O2(g)═2SO3(g)△H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是( )
| A. | 甲和乙中反应的化学平衡常数相同 | |
| B. | 乙和丙中的二氧化硫的生成速率相同 | |
| C. | 乙中SO3的体积分数大于丙 | |
| D. | 转化率:α甲(SO2)+α乙(SO3)<1 |
8.下列说法不正确的是( )
| A. | pH只适用于稀溶液,对于c(H+)>1 mol/L时,一般不用pH而直接用H+的浓度表示 | |
| B. | 水的电离、弱酸、弱碱的电离及盐类水解都是吸热的 | |
| C. | pH每增加一个单位,c(H+) 则减少10倍 | |
| D. | 25℃纯水中加入盐酸后,pH<7,此时水的离子积常数KW≠1×10-14 |
12.网传云南曲靖市越州镇约5000余吨的重毒化工废料铬渣被非法丢放,毒水被直接排放到南盘江中.
I.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是C13+,其次是Fe3+、Al3+、Ca2+、Mg2+):
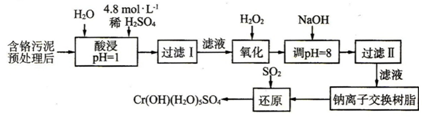
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)实验室用18.4mol/L浓硫酸配制250mL 4.8mol/L硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需250mL容量瓶、胶头滴管.
(2)加入H202的作用是氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离.调节溶液的pH=8 是为了除去Fe3+和Al3+离子.
(3)还原过程发生以下反应,请配平:
1Na2Cr2O7+3S02+11H2O═2Cr(OH)(H20)5S04+1Na2S04
(4)钠离子交换树脂的原理为Mn++nNaR═MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+.
Ⅱ.工业废水中常含有一定量的Cr2O72-和Cr042-,它们会对人类及生态系统产生很大损害,必须进行处理.其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.阳极的电极反应式为Fe-2e-=Fe2+.在阴极附近溶液pH升高的原因是2H++2e-=H2 ↑(用电极反应方程式解释).产生的阳极产物在处理废水中铬元素时所起的作用是做还原剂,将+6价的Cr还原为+3价的Cr.
I.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是C13+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | ─ | ─ | 4.7 | ─ |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)加入H202的作用是氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离.调节溶液的pH=8 是为了除去Fe3+和Al3+离子.
(3)还原过程发生以下反应,请配平:
1Na2Cr2O7+3S02+11H2O═2Cr(OH)(H20)5S04+1Na2S04
(4)钠离子交换树脂的原理为Mn++nNaR═MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+.
Ⅱ.工业废水中常含有一定量的Cr2O72-和Cr042-,它们会对人类及生态系统产生很大损害,必须进行处理.其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.阳极的电极反应式为Fe-2e-=Fe2+.在阴极附近溶液pH升高的原因是2H++2e-=H2 ↑(用电极反应方程式解释).产生的阳极产物在处理废水中铬元素时所起的作用是做还原剂,将+6价的Cr还原为+3价的Cr.
13.常温下0.1mol/L醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.1 mol/L烧碱溶液 | D. | 加入等体积0.1 mol/L盐酸 |
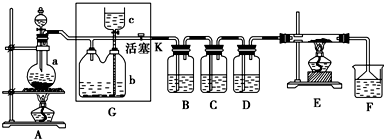
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: .
.