题目内容
13. CH4、NH3、H20和HF均为含10e-的分子.
CH4、NH3、H20和HF均为含10e-的分子.(1)C、N、O、F四种元素中,与基态C原子的核外未成对电子数相等的元素是氧(写元素名称),其基态原子的核外电子排布式为1s22s22p4.
(2)C、N、O、F四种元素第一电离能由大到小的顺序是F>N>O>C(用元素符号表示)
(3)CH4、NH3和H20分子中,从原子轨道的重叠方向来说,三种分子均含共价键类型为σ键,三种分子的中心原子的杂化轨道类型均为sp3.
(4)CH4烧生成CO、CO2和H20.
①在C0气流中轻微加热金属镍(Ni),生成无色挥发性液态Ni(CO)4,试推测四碳基镍的晶体类型为分子晶体;
②CO2、H20和NH3反应生成(NH4)2C03,根据电子对互斥理论知CO${\;}_{3}^{2-}$的空间构型为平面三角形.
(5)CH4、NH3、H2O和HF四种物质中沸点最高的是H2O(填化学式).
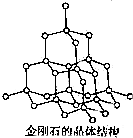
(6)SiO2的结构跟金刚石的结构相似,即SiO2的结构相当于在硅晶体结构中每个硅与硅化学键之间插入一个O原子.观察下图金刚石的结构,分析SiO2的空间结构中,Si,O形成的最小环上O原子的数目是6.
分析 (1)基态C原子的核外未成对电子数为2,O元素原子核外未成对电子数也是2;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,N元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;
(3)从原子轨道的重叠方向来说,共价键分为σ键与π键,单键为σ键,杂化轨道数目=σ键+孤电子对数,三种分子的中心原子杂化轨道数目均为4;
(4)①Ni(CO)4为无色挥发性液态,熔沸点低,应属于分子晶体;
②CO32-中孤电子对数=$\frac{4+2-2×3}{2}$0,价层电子对数=3+0=3;
(5)CH4、NH3、H2O和HF四种物质中,常温下水为液态,其它三种为气态,水的沸点最高;
(6)硅晶体中每个最小环上含有6个Si原子,形成六元环,二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子,所以Si、O原子形成的最小环上O原子的数目是6.
解答 解:(1)基态C原子的核外未成对电子数为2,N、O、F原子核外未成对电子数分别为3、2、1,O原子核外电子排布为:1s22s22p4,
故答案为:氧;1s22s22p4;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,N元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能F>N>O>C,
故答案为:F>N>O>C;
(3)从原子轨道的重叠方向来说,共价键分为σ键与π键,三种分子均形成单键,属于σ键,杂化轨道数目=σ键+孤电子对数,三种分子的中心原子杂化轨道数目均为4,均采取sp3杂化,
故答案为:σ键;sp3;
(4)①Ni(CO)4为无色挥发性液态,熔沸点低,应属于分子晶体,
故答案为:分子晶体;
②CO32-中孤电子对数=$\frac{4+2-2×3}{2}$0,价层电子对数=3+0=3,其空间结构为平面三角形,
故答案为:平面三角形;
(5)CH4、NH3、H2O和HF四种物质中,常温下水为液态,其它三种为气态,水的沸点最高,
故答案为:H2O;
(6)硅晶体中每个最小环上含有6个Si原子,形成六元环,二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子,所以Si、O原子形成的最小环上O原子的数目是6,
故答案为:6.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、化学键、晶体类型与性质、杂化方式与空间构型判断、晶胞结构等,注意理解同周期第一电离能异常情况,识记中学常见晶胞结构.

| A. | 1 L 0.1 mol/L 醋酸中含有CH3COO-数目等于0.1NA | |
| B. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 1 L 0.1 mol•L-1 Na2CO3溶液中含碳微粒总数一定为0.1NA | |
| D. | 1 L 0.1 mol•L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA |
| A. | 碳酸钙与足量盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应:H++OH-═H2O | |
| C. | 碳酸氢钠溶液与硫酸氢钠溶液反应 HCO3-+H+═CO2↑+H2O | |
| D. | 铝片插入硝酸汞溶液中:Al+Hg2+═Al3++Hg |
| A. | 熔融氢氧化钠 | B. | 石墨棒 | C. | 盐酸溶液 | D. | 固态氢氧化钾 |
| A. | 亚硫酸是SO2与水反应的产物,显酸性 | |
| B. | SO2溶于水,剧烈反应生成亚硫酸 | |
| C. | 亚硫酸具有漂白性,能够使品红溶液褪色 | |
| D. | 亚硫酸不稳定,容易分解为水和SO2 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 加热蒸干TiCl4溶液 | 产生大量固体 | 固体成分为TiCl4 |
| B | 用双氧水滴定KI淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
| C | 将K3[Fe(CN)6]溶液滴加到某溶液中 | 产生蓝色沉淀 | 该溶液中含有Fe2+ |
| D | 将SO2通入石蕊溶液中 | 溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
 .
. “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: .
.