题目内容
17.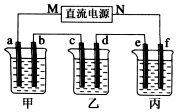 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:(1)电源的N端为正极;
(2)列式计算电极f上生成的气体在标准状况下的体积:11.2L;
(3)乙装置发生的化学反应方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4 ;
(4)简述甲装置中溶液的酸碱性变化及原因:碱性增强;因为电解了水,溶液的浓度增大;
(5)t min时乙装置中如果在电解过程中铜全部析出,此时电解能否继续进行,为什么?能; 此时电解硫酸溶液中的水.
(6)若t min后将直流电源反接在装置中,同电流再次电解2t min断开电路,通电前与电解3t min后进行比较,d电极质量变化128 g.
分析 乙为足量的CuSO4溶液,接通电源,经过一段时间后,乙中c电极质量增加,由此可知c为电解池的阴极,则d为阳极,M为负极,N为正极,a为阴极,
b为阳极,e为阴极,f为阳极;
(1)由分析可知,N为原电池的正极;
(2)测得甲中NaOH浓度为6.097%,设溶液的质量为m,则m×6.097%=100g×5.00%=5g,m=82g,电解水的质量为100g-82g=18g,即电解了1mol水,由2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑可知,转移电子2mol电子,根据电子守恒计算;
(3)乙装置中电解硫酸铜溶液,生成Cu、氧气和硫酸;
(4)甲为5.51%的NaOH溶液,电解时只有水被电解;
(5)当铜全部析出后,形成硫酸溶液;
(6)c为电解池的阴极,则d为阳极,d电极上氢氧根离子失电子生成氧气,c电极上铜离子得电子生成Cu,将直流电源反接在装置,则d为阴极,阴极上铜离子得电子生成Cu,根据电子守恒计算.
解答 解:乙为足量的CuSO4溶液,接通电源,经过一段时间后,乙中c电极质量增加,由此可知c为电解池的阴极,则d为阳极,M为负极,N为正极,a为阴极,
b为阳极,e为阴极,f为阳极;
(1)由分析可知,N为原电池的正极;故答案为:正;
(2)测得甲中NaOH浓度为6.097%,设溶液的质量为m,则m×6.097%=100g×5.00%=5g,m=82g,电解水的质量为100g-82g=18g,即电解了1mol水,由2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑可知,转移电子2mol电子,f为阳极,电极方程式为4OH--4e-=2H2O+O2↑,则生成氧气为0.5mol,即11.2L;
故答案为:11.2L;
(3)乙装置中电解硫酸铜溶液,生成Cu、氧气和硫酸,发生的化学反应方程式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
(4)甲为5.51%的NaOH溶液,电解时只有水被电解,水减少,溶液的浓度增大,碱性增强;
故答案为:碱性增强;因为电解了水,溶液的浓度增大;
(5)乙中阴极为Cu2+放电,阳极为OH-放电,电解方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,当铜全部析出后,形成硫酸溶液,通电电解时电解硫酸溶液中的水,电解可以继续进行,
故答案为:能; 此时电解硫酸溶液中的水;
(6)c为电解池的阴极,则d为阳极,d电极上氢氧根离子失电子生成氧气,c电极上铜离子得电子生成Cu,电解t min时,d电极质量不变;将直流电源反接在装置,则d为阴极,阴极上铜离子得电子生成Cu,电解2t min时,由(2)计算可知转移的电子为4mol,生成的Cu的物质的量为2mol,即128g,所以d电极质量变化128g;
故答案为:128.
点评 本题为电化学知识的综合应用,题目难度中等,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,注意串联电路中各电极上得失电子的数目相等.侧重于考查学生的分析能力和计算能力.

 阅读快车系列答案
阅读快车系列答案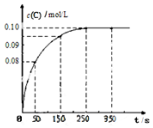 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在 0~50 s 的平均速率=1.6×10-3mo1/(L•s) | |
| B. | 该温度下,反应的平衡常数值为0.025 | |
| C. | 反应平衡后,再向容器中充入A、B、C各1mol,此时v(正)<v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 |
| A. | 平均相对分子质量 | B. | SO3(g)的转化率 | ||
| C. | $\frac{c(S{O}_{3})}{c(S{O}_{2})}$ | D. | c2(SO3) |
| A. | H2S和SO2 | B. | O2 | C. | H2S | D. | SO3 |
| A. | 参加反应的酸和碱的物质的量相等 | |
| B. | 参加反应的酸中的H+总量和碱中的OH-总量相等 | |
| C. | 反应后混合液的pH=7 | |
| D. | 不能用适当的酸碱指示剂来判断 |
| A. | 通入过量的氨气:NH4+、SO42-、Na+、AlO2- | |
| B. | 加入过量NaHCO3溶液:SO42-、Na+、Al3+、HCO3-、Fe2+ | |
| C. | 加入过量氯水:Cl-、SO42-、Fe3+、Al3+ | |
| D. | 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+、Na+ |
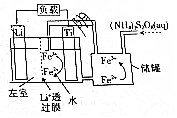
| A. | 左室电解质溶液为含Li+的水溶液 | |
| B. | 放电时,储罐中发生的离子反应为2Fe3++2SO42-═S2O82-+2Fe2+ | |
| C. | 充电时,钛极与外电源的负极相连 | |
| D. | 充电时发生的反应为Li++Fe2+$\frac{\underline{\;电解\;}}{\;}$Li+Fe3+ |
| A. | 已知电离常数H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11.H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-═SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S═PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O |
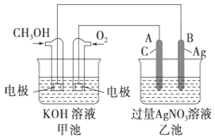 如图是一个化学过程的示意图,已知池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.
如图是一个化学过程的示意图,已知池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.