题目内容
6.一种新储能电池如图所示.下列说法正确的是( )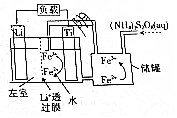
| A. | 左室电解质溶液为含Li+的水溶液 | |
| B. | 放电时,储罐中发生的离子反应为2Fe3++2SO42-═S2O82-+2Fe2+ | |
| C. | 充电时,钛极与外电源的负极相连 | |
| D. | 充电时发生的反应为Li++Fe2+$\frac{\underline{\;电解\;}}{\;}$Li+Fe3+ |
分析 该电池的负极是金属锂,离子交换膜至于许离子经过,不允许分子经过,在负极上是金属锂失电子的氧化反应,电极反应式为:Li-e-=Li+,正极上是铁离子得电子的还原反应,即Fe3++e-=Fe2+,两极反应相加,可得到总反应,在二次电池充电时,原电池的负极和电源的负极相连,原电池的正极和电源的负极相连,以此解答该题.
解答 解:A.因锂与水反应,应用非水溶剂,否则破坏原电池,故A错误;
B.放电时,储罐中加入的为(NH4)2S2O8,反应物应为S2O82-,故B错误;
C.钛电极是电池的正极,充电时,应该与外电源的正极相连,故C错误;
D.电池反应为Li+Fe3+=Li++Fe2+,则充电时发生的反应为Li++Fe2+$\frac{\underline{\;电解\;}}{\;}$Li+Fe3+,故D正确.
故选D.
点评 本题考查学生原电池和电解池的工作原理知识,为高频考点,侧重考查学生的分析能力,注意把握原电池的工作原理以及电极方程式的书写,难度不大.

练习册系列答案
相关题目
14.污水处理方法很多,属于物理方法的是( )
| A. | 中和法 | B. | 氧化还原法 | C. | 自然沉降法 | D. | 离子交换法 |
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 稀硫酸:Fe2+、Cl-、NO3-、K+ | B. | 澄清溶液:MnO4-、S2-、Na+、H+ | ||
| C. | 食盐水:K+、NO3-、SO42-、Mg2+ | D. | pH=7的溶液:Na+、HCO3-、SO42-、K+ |
18.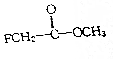 氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
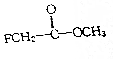 氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )| A. | 它含有两种官能团 | B. | 它属于卤代烃 | ||
| C. | 它能发生水解反应 | D. | 它属于烃的衍生物. |
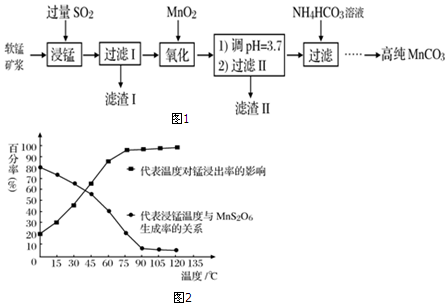
1.研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如图1:

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.PbO2的氧化性大于MnO2.
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见图2.
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节至4.7≤pH<8.3范围.
(4)阳离子吸附剂可用于除去杂质金属离子.请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子半径、金属离子电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-7.现将c mol•L-1 CaCl2溶液与2.00×10-2mol•L-1 Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-5..

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.PbO2的氧化性大于MnO2.
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见图2.
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)写出浸出过程中生成Mn2+反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节至4.7≤pH<8.3范围.
(4)阳离子吸附剂可用于除去杂质金属离子.请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子半径、金属离子电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-7.现将c mol•L-1 CaCl2溶液与2.00×10-2mol•L-1 Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-5..
2.0.2mol 气态燃料B2H6在氧气中燃烧,生成固态三氧化二硼和气态水,放出406.6kJ的热量,又知:H2O (l )═H2O(g)△H=+44kJ•mol-1,则B2H6的燃烧热为( )
| A. | 2165 kJ•mol-1 | B. | 2033 kJ•mol-1 | C. | 406.6 kJ•mol-1 | D. | 2077 kJ•mol-1 |
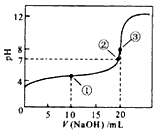 (1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.
(1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.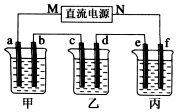 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题: