题目内容
7.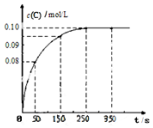 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在 0~50 s 的平均速率=1.6×10-3mo1/(L•s) | |
| B. | 该温度下,反应的平衡常数值为0.025 | |
| C. | 反应平衡后,再向容器中充入A、B、C各1mol,此时v(正)<v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 |
分析 由图象可知250s时达到平衡状态,且平衡时C的浓度为0.10mol/L,则
A(g)?B(g)+C(g)
起始(mol/L) 0.5 0 0
转化(mol/L)0.1 0.1 0.1
平衡(mol/L)0.4 0.1 0.1
以此可计算反应速率、平衡常数,以及外界条件对平衡移动的影响解答该题.
解答 解:A.由图象可知反应在 0~50 s 内C的浓度变化为0.08mol/L,则C的平均速率=$\frac{0.08mol/L}{50s}$=1.6×10-3mo1/(L•s),故A正确;
B.由以上数据可知该温度下,反应的平衡常数值为$\frac{0.1×0.1}{0.4}$=0.025,故B正确;
C.反应平衡后,再向容器中充入A、B、C各1mol,此时各物质浓度分别为0.9、0.6、0.6,则$\frac{0.6×0.6}{0.9}$=0.4>0.025,则平衡逆向移动,v(正)<v(逆),故C正确;
D.升高温度,平衡时c(B)=0.11mol/L,说明平衡正向移动,则正反应为吸热反应,故D错误.
故选D.
点评 本题综合考查化学平衡图象、化学反应速率计算、平衡常数计算、化学平衡影响因素等,为高考常见题型和高频考点,侧重考查学生的分析、计算能力,难度中等,注意C选项可以根据平衡常数计算.

练习册系列答案
相关题目
17.一定条件下,向一带活塞的密闭容器中充人 2mol SO2 和 1mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g),达到平衡后改变下述条件,SO3 气体平衡浓度不改变的是( )
| A. | 保持温度和容器体积不变,充入 1 mol SO3(g) | |
| B. | 保持温度和容器内压强不变,充入 1 mol SO3(g) | |
| C. | 保持温度和容器内压强不变,充入 1 mol O2(g) | |
| D. | 保持温度和容器内压强不变,充入 l mol Ar(g) |
2.在一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
| A. | 若增大压强,则物质Y的转化率减小 | |
| B. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| C. | 若升高温度,X的体积分数增大,则该反应的△H>0 | |
| D. | 将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
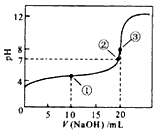 (1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.
(1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.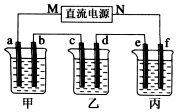 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题: