题目内容
5.标况下H2S和O2的混合气体200毫升,经点燃反应至完全,所得气体经干燥后,恢复至标况体积为20毫升,该20毫升气体可能是( )| A. | H2S和SO2 | B. | O2 | C. | H2S | D. | SO3 |
分析 H2S和O2的混合气体点燃后充分反应,如氧气足量发生2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,剩余气体可能为SO2或二者都有;如氧气不足,发生2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,剩余气体H2S,以此解答该题.
解答 解:①如氧气足量,则发生2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
如剩余气体为O2和SO2或SO2,则H2S和O2共反应200mL-20mL=180mL,则反应的H2S体积为180mL×$\frac{2}{5}$=72mL,
则生成SO2的体积为72mL>20mL,不符合题意;
②若生成产物为SO2和S,则SO2为10ml,
则先后发生 2H2S+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2S+2H2
$\frac{2}{3}×180$ $\frac{1}{3}×180$
S+O2$\frac{\underline{\;点燃\;}}{\;}$ SO2,
20ml 20ml
即H2S为120mL,O2为80mL,二者体积之和为200ml,符合题意;
③如剩余气体为H2S,则发生2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O
H2S和O2共反应200mL-20mL=180mL,则H2S为180mL×$\frac{2}{3}$+20mL=140mL,O2为180mL×$\frac{1}{3}$=60mL,二者体积之和为200ml,符合题意,
选项中只有C符合.
故选C.
点评 本题考查了混合物的计算,该题是基础性试题的考查,侧重对学生基础性知识的巩固和训练,有利于培养学生的规范答题能力,提高学生灵活运用基础知识解决实际问题的能力,难度中等.

 小学教材全测系列答案
小学教材全测系列答案| A. | a% | B. | $\frac{3}{4}$a% | C. | $\frac{6(1-a%)}{7}$ | D. | $\frac{12(1-a%)}{13}$ |
| A. | 2.5mol | B. | 4.5mol | C. | 1.5mol | D. | 0.6mol |
| A. | 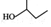 的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | B. | 氯乙烯和聚乙烯均能发生加成反应 | ||
| C. | C3H2Cl6 有4种同分异构体 | D. | C2H4和C4H8一定是同系物 |
| A. | 中和法 | B. | 氧化还原法 | C. | 自然沉降法 | D. | 离子交换法 |

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.PbO2的氧化性大于MnO2.
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见图2.
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)写出浸出过程中生成Mn2+反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节至4.7≤pH<8.3范围.
(4)阳离子吸附剂可用于除去杂质金属离子.请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子半径、金属离子电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-7.现将c mol•L-1 CaCl2溶液与2.00×10-2mol•L-1 Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-5..
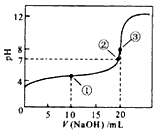 (1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.
(1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.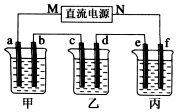 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题: