题目内容
2.向Fe和Al2O3的混合物中加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )| A. | 通入过量的氨气:NH4+、SO42-、Na+、AlO2- | |
| B. | 加入过量NaHCO3溶液:SO42-、Na+、Al3+、HCO3-、Fe2+ | |
| C. | 加入过量氯水:Cl-、SO42-、Fe3+、Al3+ | |
| D. | 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+、Na+ |
分析 加入过量硫酸溶解后过滤,滤液中含有的离子为:Fe2+、Al3+、SO42-、H+,
A.加入氨水,可生成氢氧化铝沉淀;
B.Al3+、HCO3-发生互促水解反应;
C.氯气Fe2+氧化生成Fe3+;
D.酸性条件下硝酸根离子具有强氧化性.
解答 解:加入过量硫酸溶解后过滤,滤液中含有的离子为:Fe2+、Al3+、SO42-、H+,
A.加入氨水,可生成氢氧化铝沉淀,溶液不存在AlO2-,故A错误;
B.Al3+、HCO3-发生互促水解反应,不能大量共存,故B错误;
C.氯气Fe2+氧化生成Fe3+,氯气与其它离子不反应,故C正确
D.酸性条件下硝酸根离子具有强氧化性,Fe2+不能够大量共存,故D错误.
故选C.
点评 本题考查离子共存,为高考的高频题,题目难度中等,明确滤液组成为解答关键,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
13.现有 CnH2n 和CH3COOH 的混合物,若其中氧的质量分数为a%,则其中碳元素的质量分数为( )
| A. | a% | B. | $\frac{3}{4}$a% | C. | $\frac{6(1-a%)}{7}$ | D. | $\frac{12(1-a%)}{13}$ |
10.下列关于有机化合物的说法正确的是( )
| A. | 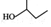 的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | B. | 氯乙烯和聚乙烯均能发生加成反应 | ||
| C. | C3H2Cl6 有4种同分异构体 | D. | C2H4和C4H8一定是同系物 |
7.下列实验所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 提取碘水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度比水中大 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 纯碱的热稳定性大于碳酸氢铵 |
| C | 分离KNO3和NaCl | 重结晶 | 硝酸钾的溶解度大于氯化钠 |
| D | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯密度大于乙醇 |
| A. | A | B. | B | C. | C | D. | D |
14.污水处理方法很多,属于物理方法的是( )
| A. | 中和法 | B. | 氧化还原法 | C. | 自然沉降法 | D. | 离子交换法 |
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 稀硫酸:Fe2+、Cl-、NO3-、K+ | B. | 澄清溶液:MnO4-、S2-、Na+、H+ | ||
| C. | 食盐水:K+、NO3-、SO42-、Mg2+ | D. | pH=7的溶液:Na+、HCO3-、SO42-、K+ |
18.下列说法正确的是( )
| A. | 氢键、分子间作用力、离子键、共价键都是微粒间的作用力,其中氢键、离子键和共价键是化学键 | |
| B. | 石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 | |
| C. | H、S、O三种元素组成的物质的水溶液与Na、S、O三种元素组成的物质的水溶液混合可能会观察到浑浊现象 | |
| D. | 测定中和热的实验中,应将酸、碱溶液一次性倒入量热装置中,并不断搅拌,待温度稳定后记下温度 |
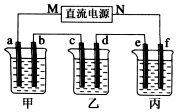 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题: