题目内容
7.下列离子方程式书写正确的是( )| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3═H2O+CO2↑ | |
| B. | 氯水与烧碱溶液反应:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| C. | 氯化亚铁溶液中滴加氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O |
分析 A.不符合反应客观事实;
B.得失电子不守恒;
C.二者反应生成氯化亚铁;
D.电荷不守恒.
解答 解:A.烧碱溶液与小苏打溶液反应生成碳酸钠和水,离子方程式:OH-+HCO3═H2O+CO32-,故A错误;
B.铝与烧碱溶液反应,离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B错误;
C.氯化亚铁溶液中滴加氯水,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D.氯气通入冷的氢氧化钠溶液中,离子方程式:Cl2+2OH-═Cl-+ClO-+H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 16g O2中所含的氧原子数为NA | |
| C. | 标准状况下,22.4L水中含有NA个水分子 | |
| D. | 标准状况下,22.4L氯化氢所含的原子数为NA |
18.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| B. | 39g Na2O2与足量水充分反应时转移的电子数为0.5NA | |
| C. | 17 g羟基与17 g氨气所含电子数均为10NA | |
| D. | 1mol/L Na2SO4溶液中离子总数为3NA |
15.液氨与纯水相似,也存在着微弱的电离:2NH3?NH4++NH2-,据此判断以下叙述中错误的是( )
| A. | NH3、NH4+、NH-的电子数相等,化学性质也相同 | |
| B. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 | |
| C. | 液氨的电离达到平衡时c(NH3)≠c(NH4+)=c(NH2-) | |
| D. | 加入其他物质,c(NH4+)/c(NH2-)可能不变 |
12.人类第一次获得金属铝是在1825年由丹麦化学家用无水AlCl 3与钾作用制得的,当时由于价格非常昂贵,称为“银色的金子”.直到19世纪后期发明了电解法生产铝,才使铝的价格大大下降,使铝成为当今广泛应用的一种金属材料.下列关于铝的叙述,不正确的是( )
| A. | 铝是地壳中含量最多的金属元素 | |
| B. | 在常温下,铝不能与浓硫酸反应 | |
| C. | 铝是一种比较活泼的金属 | |
| D. | 在化学反应中,铝容易失去电子,是还原剂 |
20.已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
aA (g)+bB (g)?2C(g)
则(1)a=3,b=1;
(2)2s内B的反应速率=0.1mol/(L•s).
aA (g)+bB (g)?2C(g)
| 起始物质的量(mol) | 3 | 2 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
(2)2s内B的反应速率=0.1mol/(L•s).
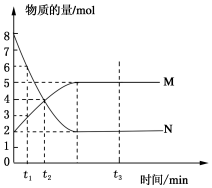 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: