题目内容
2.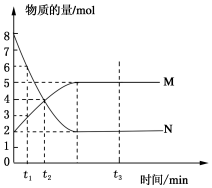 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:(1)此反应的化学方程式中a:b=2:1
(2)下列叙述中能说明上述反应达到平衡状态的是CEF.
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的平均摩尔质量不随时间的变化而变化
D.单位时间内每消耗amol N,同时生成b molm
E.混合气体的压强不随时间的变化而变化
F.在混合气体中N的质量百分数保持不变.
分析 (1)化学方程式的系数之比等于各物质的物质的量的变化量之比;
(2)当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断.
解答 解:(1)参加反应的N的物质的量为8mol-2mol=6mol,生成的M的物质的量是5mol-2mol=3mol,所以此反应的化学方程式中a:b=2:1,
故答案为:2:1;
(2)A.平衡时反应混合物各组分的物质的量不变,但各组分的物质的量不一定相等,故A错误;
B.混合气体的总质量始终不变,混合气体总质量不变不能说明到达平衡,故B错误;
C.由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的总物质的量不随时间的变化而变化,说明到达平衡,故C正确;
D.单位时间内消耗amolN,同时生成bmolM,都表示正反应速率,反应始终按此关系进行,不能说明到达平衡,故D错误;
E.由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的压强不随时间的变化而变化,说明混合气体总的物质的量再不变,说明反应到达平衡,故E正确;
F.N的质量分数在混合气体中保持不变,说明可逆反应到达最大限度平衡状态,故F正确,
故答案为:CEF.
点评 本题考查化学反应速率计算、化学平衡计算、化学平衡状态判断,题目难度不大,侧重对基础知识的巩固,注意判断化学平衡状态的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.设 NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在反应 KClO3+6HCl═KCl+3Cl2↑+3H2O 中,Cl2既是氧化产物又是还原产物,当得到标准状况下的 67.2 L Cl2 时,反应中转移的电子数为 5NA | |
| B. | 标准状况下,22.4 L 甲苯中含有的 C-H 键数目为 8NA | |
| C. | 50 g 46%的乙醇水溶液中,含氢原子总数目为 3NA | |
| D. | t℃时,MgCO3的 Ksp=4×10-6,则该温度下饱和 MgCO3溶液中含有的 Mg2+数目为 2×10-3 NA |
17. 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
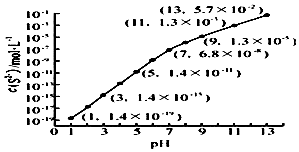
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.1已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为2HSO3-+CO32-=2SO32-+CO2↑+H2O.
 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为2HSO3-+CO32-=2SO32-+CO2↑+H2O.
7.下列离子方程式书写正确的是( )
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3═H2O+CO2↑ | |
| B. | 氯水与烧碱溶液反应:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| C. | 氯化亚铁溶液中滴加氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O |
14.已知硅酸盐中,通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.Si2O44-四面体可用图(a)表示.图(b)是一种无限长单链结构的多硅酸根,其化学式为( )

| A. | Si2O76- | B. | Si2O52- | C. | SiO32- | D. | Si4O116- |
11.已知A2-离子共含有x个中子,A元素的质量数为m,则n克A2-离子共含有电子的物质的量为( )
| A. | $\frac{n(m-x)}{m}$ | B. | $\frac{n(m-x+2)}{m}$ | C. | $\frac{m-x+2}{m-x}$ | D. | $\frac{n(m-x-2)}{m}$ |
15.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol.则前5分钟的平均反应速率v(N2)=0.01mol/(L•min).平衡时H2的转化率为50%
(2)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1>K2(填“<”“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是C(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃,当测得NH3、N2和H2物质的量分别为3mol、2mol和 1mol时,则v(N2)正>v(N2)逆
(填“<”“>”或“=”)
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol.则前5分钟的平均反应速率v(N2)=0.01mol/(L•min).平衡时H2的转化率为50%
(2)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“<”“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是C(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃,当测得NH3、N2和H2物质的量分别为3mol、2mol和 1mol时,则v(N2)正>v(N2)逆
(填“<”“>”或“=”)
 向20ml某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20ml某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示: