题目内容
19.(1)两个试剂瓶各盛装质量相同的浓硫酸和浓硝酸,分别敞口放置一段时间后,两溶液质量关系为m(硫酸)> m(硝酸)(填“>”、“<”或“=”),由于浓硫酸和浓硝酸都具有强氧化性,所以冷的浓硫酸和浓硝酸都可以用铁或铝(写金属名称)制容器盛放.(2)制备CuSO4和Cu(NO3)2
①下列有四种制备Cu(NO3)2的途径,其中最佳途径是c(选填字母)
a.Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2
b.Cu$\stackrel{浓硝酸}{→}$Cu(NO3)2
c.Cu$\stackrel{空气、△}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2
d.Cu$\stackrel{浓硫酸、△}{→}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2
②向稀硫酸溶液中加入铜粉,然后通入热空气,可制得硫酸铜溶液,则发生反应的离子方程式为Cu+O2+4H+═Cu2++2H2O.
(3)向200mL2mol/LHNO3溶液中加入足量铜粉,充分作用后,有m1g固体不溶物,继续加入100mL 1mol/L硫酸溶液,充分作用后,还有m2g固体不溶物,则 m1>m2(填
“>”、“<”或“=”),两者质量相差4.8g(若两者相等,则此问不答)
分析 (1)依据浓硫酸的吸水性、浓硝酸的挥发性,浓硫酸、浓硝酸的强氧化性解答;
(2)①最佳途径是消耗原料最少且污染最小的途径,从反应物的用量和对环境的影响考虑;
②铜粉与氧气在稀硫酸环境下发生氧化还原反应生成硫酸铜和水;
(3)硝酸根离子在酸性环境下具有强的氧化性,能够与铜反应,结合化学方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O解答.
解答 解:(1)浓硫酸具有吸水性,所以盛装浓硫酸的试剂瓶敞口放置一段时间后溶液质量增大;浓硝酸具有挥发性,所以盛装浓硝酸的试剂瓶敞口放置一段时间后溶液质量因溶质硝酸的挥发而减小,所以两个试剂瓶各盛装质量相同的浓硫酸和浓硝酸,分别敞口放置一段时间后,两溶液质量关系为m(硫酸)>m(硝酸);
浓硫酸和浓硝酸都具有强氧化性,所以冷的浓硫酸和浓硝酸都可以使铁、铝发生钝化,形成致密保护膜,阻止反应进行,所以冷的浓硫酸和浓硝酸都可以用铁或者铝制容器盛放;
故答案为:>;铁或铝;
(2)①a.Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2,依据方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,反应产生一氧化氮有毒气体,故不选;
b.Cu$\stackrel{浓硝酸}{→}$Cu(NO3)2,依据方程式:Cu与浓HNO3反应式为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,反应产生二氧化氮有毒气体,故不选;
c.Cu$\stackrel{空气、△}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2,依据方程式:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$ 2CuO;CuO+2HNO3═Cu(NO3)2+H2O,不产生有毒气体,且原料利用率高,故选;
d.Cu$\stackrel{浓硫酸、△}{→}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2,依据方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,CuSO4+Ba(NO3)2=BaSO4↓+Cu(NO3)2,反应产生二氧化硫有毒气体,故不选;
故选:c;
②铜粉与氧气在稀硫酸环境下发生氧化还原反应生成硫酸铜和水,反应的离子方程式:Cu+O2+4H+═Cu2++2H2O;
故答案为:Cu+O2+4H+═Cu2++2H2O;
(3)向200mL2mol/LHNO3溶液中加入足量铜粉,反应方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,充分作用后,有m1g固体不溶物,继续加入100mL 1mol/L硫酸溶液,溶液呈酸性,硝酸根离子在酸性环境下继续氧化铜单质,所以剩余固体不溶物m2小于m1;
200mL2mol/LHNO3溶液,硝酸的物质的量为:0.2L×2mol/L=0.4mol,依据方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,硝酸完全反应生成0.15mol硝酸铜,0.3mol硝酸根离子,加入100mL 1mol/L硫酸溶液,氢离子物质的量为:0.1L×1mol/L×2=0.2mol,依据离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
氢离子不足,依据氢离子物质的量计算溶解的铜的质量:
3Cu~8H+,
3×64 8
m 0.2
m=$\frac{3×64×0.2}{8}$=4.8g;
故答案为:>;4.8.
点评 本题考查了元素化合物知识,侧重考查浓硫酸、浓硝酸的性质及有关硝酸的计算,明确两种酸的性质是解题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱 | |
| D. | 焰火的五彩缤纷是某些金属元素的性质的展现 |
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3═H2O+CO2↑ | |
| B. | 氯水与烧碱溶液反应:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| C. | 氯化亚铁溶液中滴加氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O |
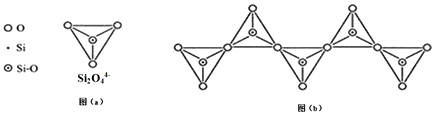
| A. | Si2O76- | B. | Si2O52- | C. | SiO32- | D. | Si4O116- |
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | pH=a 的 CH3COOH 溶液,稀释 10 倍后,其 pH=b,则 a+1<b | |
| B. | pH=5 的 H2CO3 溶液中,c(H+)=c(HCO3-)=1×10-5 mol/L | |
| C. | pH相同的①CH3COONa ②NaHCO3 ③NaCN 三种溶液的 c(Na+):①>②>③ | |
| D. | 等浓度等体积的①CH3COONa 和②NaCN 溶液,溶液中阴离子数目:②>① |
| A. | $\frac{n(m-x)}{m}$ | B. | $\frac{n(m-x+2)}{m}$ | C. | $\frac{m-x+2}{m-x}$ | D. | $\frac{n(m-x-2)}{m}$ |
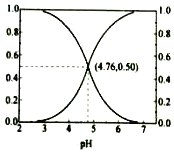 25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示.下列说法不正确的是( )
25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示.下列说法不正确的是( )| A. | 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH) | |
| B. | 在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0 | |
| C. | 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+) | |
| D. | 在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变 |
| A. | 食用醋中含有30%左右的乙酸 | |
| B. | 肥皂在碱性条件下水解可得甘油 | |
| C. | 为增加肥效,将草木灰与铵态氮肥混合施用 | |
| D. | 用pH试纸可检验食盐与假盐(NaNO2) |