题目内容
15.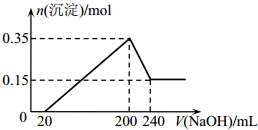 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )| A. | 生成的氢气在标准状况下的体积为11.2L | |
| B. | 最初20mLNaOH溶液用于中和过量的硫酸 | |
| C. | 硫酸的物质的量浓度为2.5mol/L | |
| D. | 镁和铝的总质量为9g |
分析 由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的0.5倍.从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,由于从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,所以该阶段消耗n(NaOH)=n[Al(OH)3]=0.2mol,氢氧化钠的浓度为:$\frac{0.2mol}{0.24L-0.20L}$=5mol/L.
A.由A中可知n(Al)=0.2mol,n(Mg)=0.15mol,根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg),据此计算n(H2),再根据V=nVm计算氢气体积;
B.由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;
C.沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的$\frac{1}{2}$,据此计算;
D.由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,据此计算.
解答 解:由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的$\frac{1}{2}$,从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,由于从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,所以该阶段消耗n(NaOH)=n[Al(OH)3]=0.2mol,氢氧化钠的浓度为:$\frac{0.2mol}{0.24L-0.20L}$=5mol/L,
A.由A中可知n(Al)=0.2mol,n(Mg)=0.15mol,根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.2mol+2×0.15mol=0.9mol,所以n(H2)=0.45mol,故氢气体积为0.45mol×22.4mol/L=10.08L,故A错误;
B.由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,故B正确;
C.沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的$\frac{1}{2}$倍,所以n(Na2SO4)=$\frac{1}{2}$×0.2L×5mol/L=0.5mol,所以硫酸的浓度为:$\frac{0.5mol}{0.2L}$=2.5mol/L,故C正确;
D.由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,所以镁和铝的总质量为0.2mol×27g/mol+0.15mol×24g/mol=9g,故D正确;
故选A.
点评 本题考查镁铝的重要化合物,以图象题的形式考查,题目难度中等,注意分析图象各阶段的物质的量的关系,根据各阶段的化学反应,利用守恒计算,试题培养了学生的分析能力及化学计算能力.

 备战中考寒假系列答案
备战中考寒假系列答案
查询资料,得25℃时有关物质的数据如表:
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到胆矾晶体中 | 固体变白 | 浓硫酸有脱水性 |
| B | 常温下将Al片放入浓硫酸中 | 无明显变化 | Al与浓硫酸不反应 |
| C | 向某溶液中加入BaCl2溶液,再向溶液中加入盐酸 | 产生白色沉淀 | 该溶液中含有SO42- |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 标准状况下,11.2L的CH2Cl2所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 常温常压下,16gO2和O3的混合气体含有的氧原子数为NA | |
| D. | 1molCaC2所含阴离子数为2NA |
 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.