题目内容
5. 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:
(1)如图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ.请写出合成氨的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1)kJ/molN2(g)+3H2(g)?2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol(热量用E1、E2或E3表示).该图中的实线与虚线部分是什么反应条件发生了变化?催化剂.
(2)在一定温度下,若将4amol H2和2amol N2放入VL的定容密闭容器中,2分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为$\frac{0.025a}{V}$摩尔/(升?秒).若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是正向正向移动(填“正向移动”“逆向移动”或“不移动”).
(3)液氨和水类似,也能电离:2NH3?NH4++NH2-,某温度时,其离子积K=2×l0-30.该温度下:①将少量NH4Cl固体加入液氨中,K==2×10-30(填“<”、“>”或“=”);
②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒物质的量大小排列为:c(NH3)>c(NH2-)>c(Na+)>c(NH4+)
(4)工厂生产的氨水作肥料时需要稀释.用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是bc.
a.$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$
b.$\frac{c(N{H}_{3}•{H}_{2}O)/}{c(O{H}^{-})}$
c.$\frac{c(O{H}^{-})}{c({H}^{+})}$
d.$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$.
分析 (1)△H=生成物能量和-反应物能量和=反应物键能和-生成物键能和=反应物活化能-生成物活化能;催化剂能够降低反应的活化能,据此解答;
(2)利用三段法计算出平衡时各物质的浓度,再计算氢气的反应速率及平衡常数,然后利用Q与K的关系来分析平衡的移动;
(3)①K是温度的函数,温度不变K值不变;
②将少量金属钠投入液氨中,2NH4++2Na=NH3↑+2Na++H2↑,导致平衡正向移动,所以离子浓度大小关系为:c(NH3)>c(NH2-)>c(Na+)>c(NH4+);
(4)NH3•H2O?NH4++OH-,用水稀释促进电离,平衡正向移动,n(NH3•H2O)减少,n(NH4+)增加,加水稀释促进一水合氨电离,溶液中c(OH-)、c(NH3.H2O)、c(NH4+)都减小,温度不变,水的离子积常数不变,则c(H+)增大.
解答 解:(1)据反应图象,先求出反应焓变,△H=反应物活化能-生成物活化能=(E1-E3)KJ/mol,即可写出热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=2(E1-E3)kJ/mol;虚线部分和实线相比,只是活化能降低了,反应物和生成物能量相等,所以,虚线部分是使用了催化剂时的能量变化图线,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1)kJ/mol;催化剂.
(2)由4amolH2和2amolN2放入VL的密闭容器中,充分反应后测得N2的转化率为50%,则
N2 +3H2 ?2NH3
开始mol/L 2×$\frac{a}{V}$ 4×$\frac{a}{V}$ 0
转化mol/L $\frac{a}{V}$ 3×$\frac{a}{V}$ 2×$\frac{a}{V}$
平衡mol/L $\frac{a}{V}$ $\frac{a}{V}$ 2×$\frac{a}{V}$
用H2表示的反应速率为=$\frac{\frac{3a}{V}}{2min}$=$\frac{3a}{2V}$mol/(L•min)=$\frac{0.025a}{V}$mol/(L•s),
K=$\frac{(\frac{2a}{V})^{2}}{(\frac{a}{V})^{4}}$=$\frac{4{V}^{2}}{{a}^{2}}$,
若此时再向该容器中投入amolH2、amolN2和2amolNH3,则浓度分别为:2×$\frac{a}{V}$mol/L; 2×$\frac{a}{V}$mol/L;4×$\frac{a}{V}$mol/L
则Q=${\frac{(\frac{4a}{V})^{2}}{(\frac{2a}{V})}}^{4}$=$\frac{{V}^{2}}{{a}^{2}}$<K,则化学平衡正向移动,
故答案为:$\frac{0.025a}{V}$mol/(L•s);正向移动;
(3)①K是温度的函数,温度不变K值不变,故答案为:=;
②2NH3?NH4++NH2-,将少量金属钠投入液氨中,2NH4++2Na=NH3↑+2Na++H2↑,平衡正向移动,所以离子浓度大小关系为c(NH3)>c(NH2-)>c(Na+)>c(NH4+),
故答案为:=,c(NH3)>c(NH2-)>c(Na+)>c(NH4+);
(4)a.$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$相当于比较$\frac{n(N{{H}_{4}}^{+})}{n(N{H}_{3}•{H}_{2}O)}$,分子增加,分母减小,所以值增大,故a错误;
b.$\frac{n(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$相当于比较$\frac{n(N{H}_{3}•{H}_{2}O)}{n(O{H}^{-})}$,分子减小,分母增加,所以值减小,故b正确;
c.$\frac{c(O{H}^{-})}{c({H}^{+})}$分子减小,分母增加,所以值减小,故c正确;
d.$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$分子增加,分母减小,所以值增大,故d错误;
故答案为:b、c;
点评 本题考查化学平衡标志的分析判断,化学反应速率概念分析应用,明确影响化学反应速率及化学平衡的影响因素,弱电解质的电离等知识,综合性较强,难度较大.明确化学平衡的特征及弱电解质电离特点是解本题的关键.

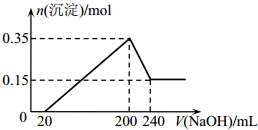 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )| A. | 生成的氢气在标准状况下的体积为11.2L | |
| B. | 最初20mLNaOH溶液用于中和过量的硫酸 | |
| C. | 硫酸的物质的量浓度为2.5mol/L | |
| D. | 镁和铝的总质量为9g |
| A. | 氨基钠和氢化钠与盐酸反应都只生成一种盐 | |
| B. | 方程式②中,每生成1mol H2转移1 mol电子 | |
| C. | 熔融氢化钠不导电 | |
| D. | 方程式①中,氨基钠是还原剂 |
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |