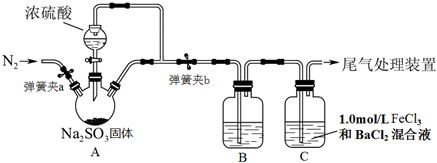
题目内容
5.如图所示装置,C、D、E、F、M、N都是惰性电极;甲、乙、丁溶液的体积均为100mL,甲中AgNO3浓度为5mol/L,乙中NaCl浓度为3mol/L.接通电源后,向乙中滴入酚酞,在F极附近显红色.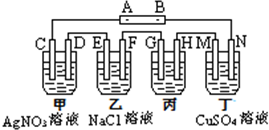
(1)电源A极的名称是正极.
(2)若用丙装置电解精练铜,则H极为纯铜(填“粗铜”或“纯铜”).
(3)甲装置中电解总反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(4)电解结束后,向丁中加入0.1molCu(OH)2,恰好恢复到反应前的浓度,则:
①丁中硫酸铜的物质的量浓度为1mol/L;
②将甲中溶液加水稀释至400mL,溶液的pH为0;
③相同条件下,乙中E、F电极上产生气体的体积比为7:8.
分析 向乙中滴入酚酞试液,在F极附近显红色,说明该极上氢离子放电,所以该电极是阴极,则A为正极,B为负极,C、E、G、M为阳极,D、F、H、N为阴极,
解答 解:向乙中滴入酚酞试液,在F极附近显红色,说明该极上氢离子放电,所以该电极是阴极,则A为正极,B为负极,C、E、G、M为阳极,D、F、H、N为阴极,
(1)由以上分析可知A为正极,故答案为:正极;
(2)用丙装置电解精练铜,则H极为阴极,应为纯铜,故答案为:纯铜;
(3)甲装置为电解硝酸银溶液,电解总反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
(4)Cu(OH)2从组成上可看成CuO•H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并电解了0.1 mol H2O,由电解的总反应式:
2H2O+?2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 转移电子
2mol 4mol
0.1mol 0.2mol
2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑转移电子
2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.4 mol.
①丁中硫酸铜完全电解生成0.1molCu,则硫酸铜的物质的量浓度为$\frac{0.1mol}{0.1L}$=1mol/L,故答案为:1mol/L;
②电解硝酸银发生4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,转移0.4mol电子,则生成0.4molHNO3,将甲中溶液加水稀释至400mL,则c(H+)=$\frac{0.4mol}{0.4L}$=1mol/L,溶液的pH为0,故答案为:0;
③n(NaCl)=0.1L×3mol/L=0.3mol,转移0.4mol电子,阳极先后发生2Cl--2e=Cl2↑、4OH--4e-═H2O+O2↑,阴极发生2H++2e-═H2↑,生成0.15mol氯气、0.025mol氧气,生成0.2mol氢气,则E、F电极上产生气体的体积比为(0.15+0.025):0.2=7:8,故答案为:7:8.
点评 本题考查了电解原理,为高频考点,侧重于学生的分析、计算能力的考查,明确电解池溶液中阴阳离子的放电顺序是解本题的关键,注意:如果活泼金属作电解池阳极时,阳极上金属失电子而不是溶液中阴离子失电子,为易错点.

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案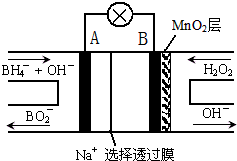 新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )| A. | 电极B为正极,纳米MnO2层的作用是提高原电池的工作效率 | |
| B. | 放电过程中,Na+从正极区向负极区迁移 | |
| C. | 电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O | |
| D. | 在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12mol |

| A. | 将水滴造型与锌块相连 | B. | 将水滴造型与电源的负极相连 | ||
| C. | 将水滴造型与电源的正极相连 | D. | 进行多次人工降雨 |
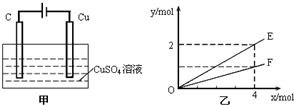
| A. | E表示生成铜的物质的量 | B. | E表示生成硫酸的物质的量 | ||
| C. | F表示反应消耗水的物质的量 | D. | E表示反应生成氧气的物质的量 |
| A. | NH3是氧化剂 | B. | NH3被氧化 | ||
| C. | NO只是还原剂 | D. | 生成60gNO转移的5mol电子 |

| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为放热反应,热效应等于E 1-E 2 | |
| C. | 反应过程 a 有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于 E 1+E 2 |
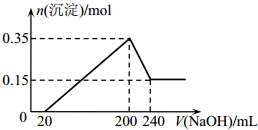 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )| A. | 生成的氢气在标准状况下的体积为11.2L | |
| B. | 最初20mLNaOH溶液用于中和过量的硫酸 | |
| C. | 硫酸的物质的量浓度为2.5mol/L | |
| D. | 镁和铝的总质量为9g |
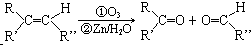

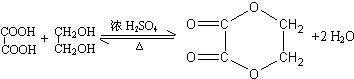 ;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、
;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、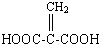 (写结构简式).
(写结构简式).