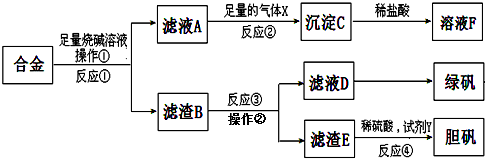
题目内容
X、Y、Z、R、T为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R和T在周期表中既处于同一周期又位于同一族,且原子序数T比R多2;Z与钠元素可以形成化合物J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.
请回答下列问题:
(1)Y基态原子的价电子排布图是 .
(2)T的基态原子的电子排布式为 ,R2+的未成对电子数是 .
(3)M中所含化学键类型是 .
(4)R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 .
请回答下列问题:
(1)Y基态原子的价电子排布图是
(2)T的基态原子的电子排布式为
(3)M中所含化学键类型是
(4)R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可化合生成气体G,其水溶液pH>7,故X为N元素,G为NH3;
Y的单质是一种黄色晶体,Y为S元素;
R、T为前四周期元素,在周期表中既处于同一周期又位于同一族,则R、T处于第Ⅷ族,且原子序数T比R多2,则R为Fe元素,T为Ni元素;
Z与钠元素可形成化合物J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L,白色沉淀L为AgCl,故Z为Cl元素,J为NaCl;
Z与氢元素形成的化合物与G反应生成M,故M为NH4Cl,
根据分析可知:X为N元素、Y为S元素、Z为Cl元素、R为Fe元素,T为Ni元素,G为NH3、L为AgCl、J为NaCl、M为NH4Cl.
Y的单质是一种黄色晶体,Y为S元素;
R、T为前四周期元素,在周期表中既处于同一周期又位于同一族,则R、T处于第Ⅷ族,且原子序数T比R多2,则R为Fe元素,T为Ni元素;
Z与钠元素可形成化合物J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L,白色沉淀L为AgCl,故Z为Cl元素,J为NaCl;
Z与氢元素形成的化合物与G反应生成M,故M为NH4Cl,
根据分析可知:X为N元素、Y为S元素、Z为Cl元素、R为Fe元素,T为Ni元素,G为NH3、L为AgCl、J为NaCl、M为NH4Cl.
解答:
解:X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可化合生成气体G,其水溶液pH>7,故X为N元素,G为NH3;
Y的单质是一种黄色晶体,Y为S元素;R、T为前四周期元素,在周期表中既处于同一周期又位于同一族,则R、T处于第Ⅷ族,且原子序数T比R多2,则R为Fe元素,T为Ni元素;Z与钠元素可形成化合物J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L,白色沉淀L为AgCl,故Z为Cl元素,J为NaCl;Z与氢元素形成的化合物与G反应生成M,故M为NH4Cl,
则:X为N元素、Y为S元素、Z为Cl元素、R为Fe元素,T为Ni元素,G为NH3、L为AgCl、J为NaCl、M为NH4Cl,
(1)Y为S元素,S原子最外层6个电子,价电子的排布式为:3s23p4,2p轨道中4个电子,且有2个单电子,其价电子轨道排布图为: ,
,
故答案为: ;
;
(2)T为Ni,为28号元素,其基态原子的电子排布式为:1s22s22p63s23p63d84s2;
Fe2+的核外电子排布式为:1s24s22p63s23d6,3d能级有4个未成对电子,
故答案为:1s24s22p63s23d6;4;
(3)M为NH4Cl,属于离子晶体,氯化铵中含有的化学键为离子键、共价键,
故答案为:离子键、共价键;
(4)R的含氧酸跟RO42-为FeO42-,向其钠盐溶液中加入硫酸,溶液变黄,说明生成Fe3+,并有无色气体生成,反应中Fe的化合价降低,只能是O元素的化合价升高,则无色气体比为O2,反应的离子方程式为:4FeO42-+20H+═4Fe3++3O2↑+10H2O,
故答案为:4FeO42-+20H+=4Fe3++3O2↑+10H2O.
Y的单质是一种黄色晶体,Y为S元素;R、T为前四周期元素,在周期表中既处于同一周期又位于同一族,则R、T处于第Ⅷ族,且原子序数T比R多2,则R为Fe元素,T为Ni元素;Z与钠元素可形成化合物J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L,白色沉淀L为AgCl,故Z为Cl元素,J为NaCl;Z与氢元素形成的化合物与G反应生成M,故M为NH4Cl,
则:X为N元素、Y为S元素、Z为Cl元素、R为Fe元素,T为Ni元素,G为NH3、L为AgCl、J为NaCl、M为NH4Cl,
(1)Y为S元素,S原子最外层6个电子,价电子的排布式为:3s23p4,2p轨道中4个电子,且有2个单电子,其价电子轨道排布图为:
 ,
,故答案为:
 ;
;(2)T为Ni,为28号元素,其基态原子的电子排布式为:1s22s22p63s23p63d84s2;
Fe2+的核外电子排布式为:1s24s22p63s23d6,3d能级有4个未成对电子,
故答案为:1s24s22p63s23d6;4;
(3)M为NH4Cl,属于离子晶体,氯化铵中含有的化学键为离子键、共价键,
故答案为:离子键、共价键;
(4)R的含氧酸跟RO42-为FeO42-,向其钠盐溶液中加入硫酸,溶液变黄,说明生成Fe3+,并有无色气体生成,反应中Fe的化合价降低,只能是O元素的化合价升高,则无色气体比为O2,反应的离子方程式为:4FeO42-+20H+═4Fe3++3O2↑+10H2O,
故答案为:4FeO42-+20H+=4Fe3++3O2↑+10H2O.
点评:本题考查结构性质位置关系,涉及无机物的推断、核外电子排布规律、杂化理论、氧化还原反应等知识,难度中等,注意掌握原子结构与元素周期表、元素周期律的关系,(4)中注意根据氧化还原反应知识判断生成的气体是氧气,是易错点与难点.

练习册系列答案
相关题目
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: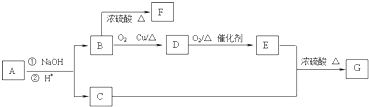
 (1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.
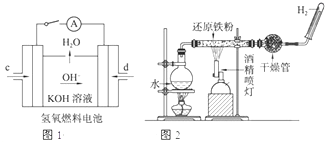
(1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol. 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下: