题目内容
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
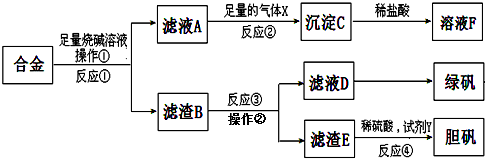
请回答下列问题:
(1)铁在元素周期表中的位置是 .
(2)写出反应①的化学方程式 ,反应②生成沉淀的离子反应方程式 .
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):
.
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 .
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L.

请回答下列问题:
(1)铁在元素周期表中的位置是
(2)写出反应①的化学方程式
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为
考点:金属的回收与环境、资源保护
专题:实验设计题
分析:合金加入足量的烧碱溶液后,金属铝溶解,滤渣为铁、铜;滤液A中通入二氧化碳气体,得到氢氧化铝沉淀;滤渣B加入稀硫酸,铁与稀硫酸反应,且会形成铁铜原电池,滤渣E溶解于稀硝酸,蒸发结晶得到绿矾,据此分析.
(1)26号元素铁在元素周期表中的位置是:第四周期ⅠB族;
(2)金属铝可以和强碱发生反应生成偏铝酸盐和氢气;偏铝酸盐可以和二氧化碳气体反应生成氢氧化铝沉淀;
(3)滤液D中含有的金属离子是亚铁离子,根据亚铁离子的检验方法来回答;
(4)在滤渣B中滴加稀硫酸时,溶液中铜、铁与稀硫酸形成了原电池;
(5)双氧水是一种绿色氧化剂,可以实现金属铜和硫酸之间的反应,由铜和硝酸、硫酸反应化学方程式求算.
(1)26号元素铁在元素周期表中的位置是:第四周期ⅠB族;
(2)金属铝可以和强碱发生反应生成偏铝酸盐和氢气;偏铝酸盐可以和二氧化碳气体反应生成氢氧化铝沉淀;
(3)滤液D中含有的金属离子是亚铁离子,根据亚铁离子的检验方法来回答;
(4)在滤渣B中滴加稀硫酸时,溶液中铜、铁与稀硫酸形成了原电池;
(5)双氧水是一种绿色氧化剂,可以实现金属铜和硫酸之间的反应,由铜和硝酸、硫酸反应化学方程式求算.
解答:
解:合金加入足量的烧碱溶液后,金属铝溶解,滤渣为铁、铜;滤液A中通入二氧化碳气体,得到氢氧化铝沉淀;滤渣B加入稀硫酸,铁与稀硫酸反应,且会形成铁铜原电池,滤渣E溶解于稀硝酸,蒸发结晶得到绿矾,据此分析.
(1)26号元素铁在元素周期表中的位置是:第四周期ⅠB族,
故答案为:第四周期ⅠB族;
(2)金属铝可以和强碱氢氧化钠发生反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑,偏铝酸钠溶液中通入过量二氧化碳,生成氢氧化铝沉淀,即AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)亚铁离子可以和强碱反应生成氢氧化亚铁沉淀,迅速被氧化为氢氧化铁,故亚铁离子的检验方法:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,
故答案为:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色;
(4)在滤渣B中滴加稀硫酸时,溶液中铜、铁与稀硫酸形成了许多微小的原电池,构成了电化学腐蚀,加快了反应速率,
故答案为:铜、铁与稀硫酸形成了原电池;
(5)双氧水是一种绿色氧化剂,在双氧水的作用下,金属铜可以和硫酸发生反应:Cu+H2O2+H2SO4=CuSO4+2H2O,铜和硝酸、硫酸反应化学方程式:3Cu+2HNO3+3H2SO=3CuSO4++2NO↑+4H2O,3mol Cu全部溶解消耗硝酸2mol,则该硝酸的体积=
=2L,
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;2.
(1)26号元素铁在元素周期表中的位置是:第四周期ⅠB族,
故答案为:第四周期ⅠB族;
(2)金属铝可以和强碱氢氧化钠发生反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑,偏铝酸钠溶液中通入过量二氧化碳,生成氢氧化铝沉淀,即AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)亚铁离子可以和强碱反应生成氢氧化亚铁沉淀,迅速被氧化为氢氧化铁,故亚铁离子的检验方法:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,
故答案为:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色;
(4)在滤渣B中滴加稀硫酸时,溶液中铜、铁与稀硫酸形成了许多微小的原电池,构成了电化学腐蚀,加快了反应速率,
故答案为:铜、铁与稀硫酸形成了原电池;
(5)双氧水是一种绿色氧化剂,在双氧水的作用下,金属铜可以和硫酸发生反应:Cu+H2O2+H2SO4=CuSO4+2H2O,铜和硝酸、硫酸反应化学方程式:3Cu+2HNO3+3H2SO=3CuSO4++2NO↑+4H2O,3mol Cu全部溶解消耗硝酸2mol,则该硝酸的体积=
| 2mol |
| 1mol/L |
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;2.
点评:本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息.本题难度中.

练习册系列答案
相关题目
下列有关实验的叙述正确的是( )
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、用萃取分液的方法除去酒精中的水 |
| C、用可见光束照射以区别溶液和胶体 |
| D、根据火焰所呈现的特征焰色,只能检验金属离子的存在 |
鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )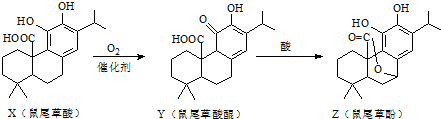

| A、X、Y、Z互为同分异构体 |
| B、X、Z均能与FeCl3溶液发生显色反应 |
| C、X、Y、Z分子中均含有2个手性碳原子 |
| D、1molX与NaOH溶液反应最多消耗3molNaOH |
常温下,用0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL 0.10mol?L-1CH3COOH溶液,得到2条滴定曲线,如图所示,则下列说法正确的是( )
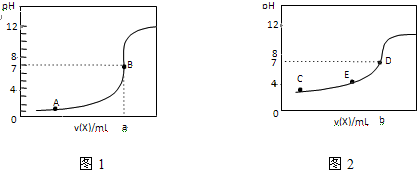

| A、图2是滴定盐酸的曲线 |
| B、a与b的关系是:a<b |
| C、E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、这两次滴定都可以用甲基橙作为指示剂 |
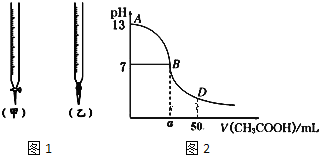
 (1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应: