题目内容
 (1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.
(1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.则反应C(s)+CO2(g)=2CO(g)的△H3=
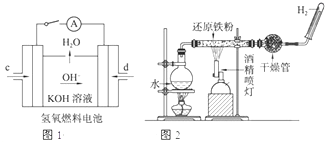
(2)如图所示装置工作时均与H2有关.
①图1所示装置中,通入H2的管口的电极反应式为
②某同学按图2所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2.该结论
(3)常温下,将1.92g铜投入到100mL稀硫酸和稀硝酸的混合溶液中,铜全部溶解并放出无色气体.再向溶液中加入足量铁粉成分反应,此时只收集到448mL氢气(已换算成标况).
①原溶液中硝酸的物质的量为
考点:热化学方程式,化学方程式的有关计算,化学电源新型电池
专题:
分析:(1)利用盖斯定律计算反应热;
(2)①根据在燃料电池中,可燃性气体在负极发生氧化反应,结合电解质溶液是KOH溶液来书写电极反应式;
②根据反应现象知,溶液中没有铁离子,原因是部分铁未被氧化,导致剩余的铁和铁离子反应生成亚铁离子.
(3)常温下,将铜加入到H2SO4和HNO3的混合液中,发生反应3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O,Cu全部溶解,放出无色气体为NO,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气,说明硫酸有剩余,硝酸全部起氧化剂作用.加入的铁发生反应Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑,置换出溶液中的铜、与氢气,据此分析.
(2)①根据在燃料电池中,可燃性气体在负极发生氧化反应,结合电解质溶液是KOH溶液来书写电极反应式;
②根据反应现象知,溶液中没有铁离子,原因是部分铁未被氧化,导致剩余的铁和铁离子反应生成亚铁离子.
(3)常温下,将铜加入到H2SO4和HNO3的混合液中,发生反应3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O,Cu全部溶解,放出无色气体为NO,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气,说明硫酸有剩余,硝酸全部起氧化剂作用.加入的铁发生反应Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑,置换出溶液中的铜、与氢气,据此分析.
解答:
解:(1)已知:①BaSO4(s)+4C(s)═4CO(s)+BaS(s)△H=+571.2KJ/mol,
②BaSO4(s)+2C(s)═2CO2(s)+BaS(s)△H=+226.2KJ/mol,
利用盖斯定律将
可得:C(s)+CO2(g)═CO(g);
△H=
=+172.5kJ/mol,
故答案为:C(s)+CO2(g)═CO(g)△H=+172.5KJ/mol;
(2)①根据在燃料电池中,可燃性气体氢气在负极发生氧化反应,而电解质溶液是KOH溶液,故电极反应式为:H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
②铁和水蒸气在高温下反应生成四氧化三铁和氢气,根据反应现象知,该反应中部分铁未参加反应导致剩余的铁和铁离子反应生成二价铁离子,离子方程式为:2Fe3++Fe=3Fe2+,所以说不严密.
故答案为:不严密;
(3)常温下,将铜加入到H2SO4和HNO3的混合液中,发生反应3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O,Cu全部溶解,放出无色气体为NO,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气,说明硫酸有剩余,硝酸全部起氧化剂作用.加入的铁发生反应Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑,置换出溶液中的铜、与氢气.
①铜的物质的量n(Cu)=
=0.03mol,根据3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O可知,原溶液中n(NO3-)=
×0.03mol=0.02mol,故答案为:0.02;
②加入的铁发生反应:Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑,n(Cu)=
=0.03mol,n(H2)=
=0.02mol,加入足量铁粉后的溶液中溶质是硫酸亚铁,由离子方程式可知n(Fe)=n(Cu)+n(H2)=0.03mol+0.02mol=0.05mol,质量m=nM=0.05mol×56g/mol=2.8g,故答案为:2.8.
②BaSO4(s)+2C(s)═2CO2(s)+BaS(s)△H=+226.2KJ/mol,
利用盖斯定律将
| ①-② |
| 2 |
△H=
| 571.2KJ/mol-226.2KJ/mol |
| 2 |
故答案为:C(s)+CO2(g)═CO(g)△H=+172.5KJ/mol;
(2)①根据在燃料电池中,可燃性气体氢气在负极发生氧化反应,而电解质溶液是KOH溶液,故电极反应式为:H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
②铁和水蒸气在高温下反应生成四氧化三铁和氢气,根据反应现象知,该反应中部分铁未参加反应导致剩余的铁和铁离子反应生成二价铁离子,离子方程式为:2Fe3++Fe=3Fe2+,所以说不严密.
故答案为:不严密;
(3)常温下,将铜加入到H2SO4和HNO3的混合液中,发生反应3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O,Cu全部溶解,放出无色气体为NO,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气,说明硫酸有剩余,硝酸全部起氧化剂作用.加入的铁发生反应Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑,置换出溶液中的铜、与氢气.
①铜的物质的量n(Cu)=
| 1.92g |
| 64g/mol |
| 2 |
| 3 |
②加入的铁发生反应:Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑,n(Cu)=
| 1.92g |
| 64g/mol |
| 0.448L |
| 22.4L/mol |
点评:本题考查了盖斯定律、混合物的计算、硝酸性质等,难度中等,注意在足量的混酸中硝酸全起氧化剂作用,根据题目信息判断发生的反应是解题关键.

练习册系列答案
相关题目
鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )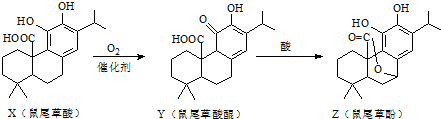

| A、X、Y、Z互为同分异构体 |
| B、X、Z均能与FeCl3溶液发生显色反应 |
| C、X、Y、Z分子中均含有2个手性碳原子 |
| D、1molX与NaOH溶液反应最多消耗3molNaOH |
下列说法正确的是( )
| A、刚玉的主要成分是二氧化硅,红宝石、蓝宝石是含少量不同金属氧化物的优质刚玉 |
| B、蛋白质水解后只生成一种纯净的物质--氨基酸 |
| C、所有金属及其化合物在火焰上灼烧,都会使火焰呈现特征颜色,即焰色反应 |
| D、生铁比纯铁易受腐蚀,减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力 |
 已知A、B、C、D、E五种短周期的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是次外层的3倍.
已知A、B、C、D、E五种短周期的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是次外层的3倍.
 、CH2=CH2可以用键线式
、CH2=CH2可以用键线式 表示,两者可以发生如下反应:
表示,两者可以发生如下反应: 试回答下列问题:
试回答下列问题: A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素.已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个单电子,G的核电荷数比F多5.请回答下列问题(用相应的元素符号、化学式和化学术语填空)
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素.已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个单电子,G的核电荷数比F多5.请回答下列问题(用相应的元素符号、化学式和化学术语填空)