题目内容
A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A ,B ,C .
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最小的元素是 ,电负性最大的元素是 .
(3)D的氢化物比C的氢化物的沸点 (填“高“或“低“),原因 .
(4)E元素原子的核电荷数是 ,E元素在周期表的位置是 ,已知元素周期表可按电子排布分为s区、p区等,则E元素在 区.
(5)画出D的核外电子排布图 ,这样排布遵循了构造原理、 原理和 .
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:A
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最小的元素是
(3)D的氢化物比C的氢化物的沸点
(4)E元素原子的核电荷数是
(5)画出D的核外电子排布图
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;
A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素;
C的最外层有三个成单电子,即C原子的3p能级有3个电子,故C为P元素;
C、D同主族,故D为N元素;
E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,结合元素、位置的结构和性质分析解答.
A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素;
C的最外层有三个成单电子,即C原子的3p能级有3个电子,故C为P元素;
C、D同主族,故D为N元素;
E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,结合元素、位置的结构和性质分析解答.
解答:
解:依据分析可知:A为硅,B为钠,C为磷,D为氮,E为铁,
(1)A为硅,B为钠,C为磷,元素符号分别为:Si、Na、P,故答案为:Si、Na、P;
(2)同周期自左而右,第一电离能呈增大趋势,但第IIA族元素、第VA族元素大于相邻元素,所以第一电离能最小的元素是Li,同周期元素自左而右,元素的电负性增大,故电负性最大的元素是F,故答案为:Li;F;
(3)D的氢化物是NH3,C的氢化物是PH3,分子晶体中物质的沸点随着相对分子质量的增大而增大,氨气分子中含有氢键,PH3中不含氢键,氢键的存在导致氨气的沸点大于PH3,故答案为:高;氨气分子间形成氢键;
(4)E是Fe元素,原子序数为26,铁元素位于第四周期第VIII族,处于d区,故答案为:26;第四周期第VIII族;d;
(5)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子,所以其核外电子排布图为: ,这样排布遵循了能量最低原理、泡利不相容原理、洪特规则,
,这样排布遵循了能量最低原理、泡利不相容原理、洪特规则,
故答案为: ;泡利;洪特.
;泡利;洪特.
(1)A为硅,B为钠,C为磷,元素符号分别为:Si、Na、P,故答案为:Si、Na、P;
(2)同周期自左而右,第一电离能呈增大趋势,但第IIA族元素、第VA族元素大于相邻元素,所以第一电离能最小的元素是Li,同周期元素自左而右,元素的电负性增大,故电负性最大的元素是F,故答案为:Li;F;
(3)D的氢化物是NH3,C的氢化物是PH3,分子晶体中物质的沸点随着相对分子质量的增大而增大,氨气分子中含有氢键,PH3中不含氢键,氢键的存在导致氨气的沸点大于PH3,故答案为:高;氨气分子间形成氢键;
(4)E是Fe元素,原子序数为26,铁元素位于第四周期第VIII族,处于d区,故答案为:26;第四周期第VIII族;d;
(5)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子,所以其核外电子排布图为:
 ,这样排布遵循了能量最低原理、泡利不相容原理、洪特规则,
,这样排布遵循了能量最低原理、泡利不相容原理、洪特规则,故答案为:
 ;泡利;洪特.
;泡利;洪特.
点评:本题主要考查元素推断、元素周期律、核外电子排布规律、常用化学用语等,难度不大,推断元素是解题的关键,难度中等.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
加热NH4HCO3固体,使产生的气体依次通过盛有过量Na2O2的干燥管、浓H2SO4的洗气瓶,最后得到的气体是 ( )
| A、O2 |
| B、NH3 |
| C、CO2 |
| D、CO2和O2 |
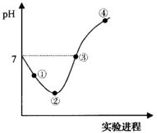 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol?L-1的氢氧化钠溶液,整个过程中pH( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol?L-1的氢氧化钠溶液,整个过程中pH( )| A、①点所示溶液中:c(H+)=c(Cl-)+c(ClO-) |
| B、②点所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) |
| C、③点所示溶液中:c(Na+)=c(HClO)+2c(ClO-) |
| D、④点所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
电解84.7mL质量分数为16%的氢氧化钠溶液(密度为1.18g?cm-3),过一段时间后,电解所得溶液中溶质的质量分数为19.5%(用石墨为电极),这是因为( )
| A、溶质增加了3.5 g |
| B、有1.5 mol水被电解 |
| C、在阳极生成2 g H2 |
| D、在阳极生成16 g O2 |
 已知A、B、C、D、E五种短周期的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是次外层的3倍.
已知A、B、C、D、E五种短周期的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是次外层的3倍.