题目内容
将相同质量的两份铁反别投入1mol/L、体积均为200mL的盐酸、硫酸两份溶液中,放出H2的体积比为2:3,则每份金属铁的质量是( )
| A、2.8g | B、5.6g |
| C、8.4g | D、11.2g |
考点:化学方程式的有关计算
专题:计算题
分析:发生反应为:Fe+2HCl═FeCl2+H2↑①、Fe+H2SO4═FeSO4+H2↑②,加入铁粉质量相等,如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,根据反应①可以算出来生成H2为0.1mol,根据体积比可算出来②反应生成H2为0.15mol,而反应②中Fe不足,进而计算铁的质量.
解答:
解:发生反应为:Fe+2HCl═FeCl2+H2↑①、Fe+H2SO4═FeSO4+H2↑②,加入铁粉质量相等,
如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,
若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,
而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,
反应①生成气体的物质的量为
=0.1mol,反应完毕后生成气体的体积之比为2:3,所以由硫酸生成的气体为0.1mol×
=0.15mol,
设铁的质量为x,则:
Fe+H2SO4═FeSO4+H2↑②
56g 1mol
x 0.15mol
所以,56g:x=1mol:0.15mol,解得x=8.4g,
故选C.
如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,
若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,
而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,
反应①生成气体的物质的量为
| 0.1L×2mol/L |
| 2 |
| 3 |
| 2 |
设铁的质量为x,则:
Fe+H2SO4═FeSO4+H2↑②
56g 1mol
x 0.15mol
所以,56g:x=1mol:0.15mol,解得x=8.4g,
故选C.
点评:本题考查过量计算、根据方程式计算,本题关键是通过反应方程式及生成氢气体积关系判断反应的过量问题,题目难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ |
| B、钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ |
| C、NaHCO3溶液与稀H2SO4反应:HCO3-+H+═H2O+CO2↑ |
| D、向FeCl3溶液中加入Ba(OH)2:3Ba(OH)2+2Fe3+═2Fe(OH)3+3Ba2+ |
分子式为C9H12的所有带苯环结构的异构体中,在催化剂条件下与液溴发生取代反应,其一溴代物为三种的结构有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
把Ca(OH)2放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),加入以下固体,能使Ca(OH)2减少的是( )
| A、NaOH |
| B、Na2CO3 |
| C、CaCl2 |
| D、NaClO |
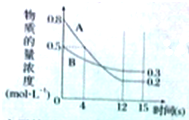 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.