题目内容
含1mol氯化铁和1mol氯化铜的混合溶液中,加入56g铁粉,会生成 克铜.
考点:铁的化学性质,化学方程式的有关计算
专题:元素及其化合物
分析:n(Fe)=
=1mol,因氧化性:Fe3+>Cu2+,在氯化铁和氯化铜的混合溶液中加入铁粉,分别发生:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,结合反应的离子方程式计算.
| 56g |
| 56g/mol |
解答:
解:n(Fe)=
=1mol,因氧化性:Fe3+>Cu2+,
则首先发生2Fe3++Fe=3Fe2+,
1mol 0.5mol
则1mol氯化铁消耗0.5molFe,还剩0.5molFe,
其次发生,Fe+Cu2+=Fe2++Cu,
0.5mol 0.5mol
则可生产0.5molCu,质量为0.5mol×64g/mol=32g,
故答案为:32.
| 56g |
| 56g/mol |
则首先发生2Fe3++Fe=3Fe2+,
1mol 0.5mol
则1mol氯化铁消耗0.5molFe,还剩0.5molFe,
其次发生,Fe+Cu2+=Fe2++Cu,
0.5mol 0.5mol
则可生产0.5molCu,质量为0.5mol×64g/mol=32g,
故答案为:32.
点评:本题考查方程式的计算,为高频考点,侧重于学生的分析、计算能力的考查,本题注意氧化性的强弱以及反应的先后顺序,为解答该题的关键,难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
将相同质量的两份铁反别投入1mol/L、体积均为200mL的盐酸、硫酸两份溶液中,放出H2的体积比为2:3,则每份金属铁的质量是( )
| A、2.8g | B、5.6g |
| C、8.4g | D、11.2g |
下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数的2.5倍,B元素的原子核内质子数等于中子数,下列叙述不正确的是( )
| B | ||
| A | C |
| A、A为ⅤA族元素 |
| B、B为第二周期的元素 |
| C、C是周期表中化学性质最活泼的非金属 |
| D、三种元素都为非金属元素 |
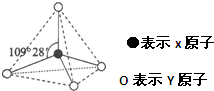
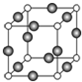 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.