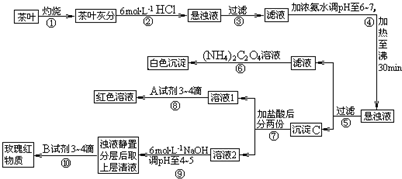
题目内容
把Ca(OH)2放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),加入以下固体,能使Ca(OH)2减少的是( )
| A、NaOH |
| B、Na2CO3 |
| C、CaCl2 |
| D、NaClO |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:使溶解平衡:Ca(OH)2(s)?Ca2++2OH-,向正方向移动,有利于Ca(OH)2减少,可以加入水,或降低
Ca2+、OH-的浓度等.
Ca2+、OH-的浓度等.
解答:
解:A.加入NaOH溶液,溶液中OH-浓度增大,抑制氢氧化钙的溶解,故A错误;
B.加入Na2CO3,转化为碳酸钙沉淀,Ca2+的浓度降低,平衡向右移动,促进氢氧化钙的溶解,故B正确;
C.加入CaCl2溶液,溶液中Ca2+浓度增大,抑制氢氧化钙的溶解,不利于Ca(OH)2减少,故C错误;
D.加入NaaClO,次氯酸根水解,溶液碱性增强,溶液中OH-浓度增大,抑制氢氧化钙的溶解,故D错误;
故选B.
B.加入Na2CO3,转化为碳酸钙沉淀,Ca2+的浓度降低,平衡向右移动,促进氢氧化钙的溶解,故B正确;
C.加入CaCl2溶液,溶液中Ca2+浓度增大,抑制氢氧化钙的溶解,不利于Ca(OH)2减少,故C错误;
D.加入NaaClO,次氯酸根水解,溶液碱性增强,溶液中OH-浓度增大,抑制氢氧化钙的溶解,故D错误;
故选B.
点评:本题考查难溶电解质的溶解平衡,注意利用平衡移动原理进行分析,难度不大,注意温度对平衡移动的影响,Ca(OH)2的溶解度随温度的升高而降低.

练习册系列答案
 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
将相同质量的两份铁反别投入1mol/L、体积均为200mL的盐酸、硫酸两份溶液中,放出H2的体积比为2:3,则每份金属铁的质量是( )
| A、2.8g | B、5.6g |
| C、8.4g | D、11.2g |
下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数的2.5倍,B元素的原子核内质子数等于中子数,下列叙述不正确的是( )
| B | ||
| A | C |
| A、A为ⅤA族元素 |
| B、B为第二周期的元素 |
| C、C是周期表中化学性质最活泼的非金属 |
| D、三种元素都为非金属元素 |
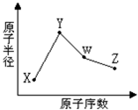 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.