题目内容
己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大.X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:
(1)YW2的电子式 ;V原子的结构示意图 ;Z的氢化物结构式为 ;写出U元素在周期表中的位置N2W2中含有的化学键的种类 .
(2)从化合价升降的角度推测UW2与V元素的单质在水溶液中反应的化学方程式是 .
(3)N2W2与H2O反应的化学方程式是 .
(4)UW2与NaOH溶液反应的离子方程式是 .
(1)YW2的电子式
(2)从化合价升降的角度推测UW2与V元素的单质在水溶液中反应的化学方程式是
(3)N2W2与H2O反应的化学方程式是
(4)UW2与NaOH溶液反应的离子方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大,Y原子的L层电子数是K层电子数的2倍,则Y核外电子数=2+4=6,所以Y是C元素;Z、W的单质常温下均为无色气体,且原子序数大于Y,所以Z是N元素、W是O元素;X与N同主族,且与W都能形成A2B、A2B2型化合物,X原子序数小于N,在X是H元素、N是Na元素;U原子的最外层电子数是其电子层数的2倍,其最外层电子数是6,且原子序数大于11,所以U是S元素;V是短周期主族元素,其原子序数大于U,所以V是Cl元素,据此答题.
解答:
解:X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大,Y原子的L层电子数是K层电子数的2倍,则Y核外电子数=2+4=6,所以Y是C元素;Z、W的单质常温下均为无色气体,且原子序数大于Y,所以Z是N元素、W是O元素;X与N同主族,且与W都能形成A2B、A2B2型化合物,X原子序数小于N,在X是H元素、N是Na元素;U原子的最外层电子数是其电子层数的2倍,其最外层电子数是6,且原子序数大于11,所以U是S元素;V是短周期主族元素,其原子序数大于U,所以V是Cl元素,
(1)CO2的电子式为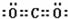 ;V是Cl元素,其原子核外有3个电子层、最外层电子数是7,则Cl原子的结构示意图为
;V是Cl元素,其原子核外有3个电子层、最外层电子数是7,则Cl原子的结构示意图为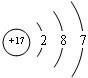 ;Z是N元素,氮元素氢化物的结构式为
;Z是N元素,氮元素氢化物的结构式为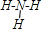 ;U是S元素,S元素在周期表中的位置是第三周期第VIA族;Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键,所以过氧化钠中含有的化学键有离子键和共价键,
;U是S元素,S元素在周期表中的位置是第三周期第VIA族;Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键,所以过氧化钠中含有的化学键有离子键和共价键,
故答案为: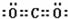 ;
; ;
;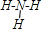 ;离子键和共价键;
;离子键和共价键;
(2)SO2与氯气在水溶液中发生氧化还原反应生成盐酸和硫酸,化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4,故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;
(3)Na2O2与H2O反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)SO2与NaOH溶液反应的离子方程式是SO2+2OH-=H2O+SO32-,故答案为:SO2+2OH-=H2O+SO32-.
(1)CO2的电子式为
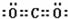 ;V是Cl元素,其原子核外有3个电子层、最外层电子数是7,则Cl原子的结构示意图为
;V是Cl元素,其原子核外有3个电子层、最外层电子数是7,则Cl原子的结构示意图为 ;Z是N元素,氮元素氢化物的结构式为
;Z是N元素,氮元素氢化物的结构式为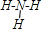 ;U是S元素,S元素在周期表中的位置是第三周期第VIA族;Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键,所以过氧化钠中含有的化学键有离子键和共价键,
;U是S元素,S元素在周期表中的位置是第三周期第VIA族;Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键,所以过氧化钠中含有的化学键有离子键和共价键,故答案为:
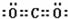 ;
; ;
;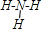 ;离子键和共价键;
;离子键和共价键;(2)SO2与氯气在水溶液中发生氧化还原反应生成盐酸和硫酸,化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4,故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;
(3)Na2O2与H2O反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)SO2与NaOH溶液反应的离子方程式是SO2+2OH-=H2O+SO32-,故答案为:SO2+2OH-=H2O+SO32-.
点评:本题主要考查了电子式、结构式、化学键、氧化还原反应、离子反应等知识,难度不大,元素推断是解题的关键,答题时注意常见化学用语的正确书写.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
下列溶液中的氯离子数目与50mL 1mol/L的AlCl3溶液中氯离子数目相等的是( )
| A、150 mL 1 mol/L的NaCl溶液 |
| B、75 mL 1 mol/L的NH4Cl溶液 |
| C、150 mL 3 mol/L的KCl溶液 |
| D、75 mL 2 mol/L的CaCl2溶液 |
足量Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr混合溶液中,在此过程中溶液的pH与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)( )
A、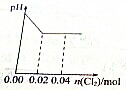 |
B、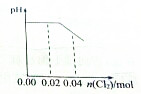 |
C、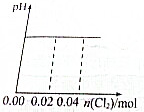 |
D、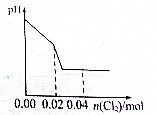 |
将相同质量的两份铁反别投入1mol/L、体积均为200mL的盐酸、硫酸两份溶液中,放出H2的体积比为2:3,则每份金属铁的质量是( )
| A、2.8g | B、5.6g |
| C、8.4g | D、11.2g |

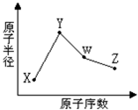 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.