题目内容
2.下列有机物的命名中,正确的是( )| A. | 3,3二甲基4乙基戊烷 | B. | 2,5,5三甲基己烷 | ||
| C. | 2,3二甲基丁烯 | D. | 3甲基1戊炔 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.主链不是最长,名称为:3,3,4-三甲基己烷,故A错误;
B.取代基的位次和不是最小,名称为:2,2,5三甲基己烷,故B错误;
C.符合命名规则,故C正确;
D.符合命名规则,故D正确.
故选CD.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性知识的考查,侧重对学生基础知识的检验和训练.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
4.用NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1molCu和足量热浓硫酸反应可生成SO3分子数为0.1NA | |
| B. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| C. | 常温常压下,6.0g SiO2含有的SiO2分子数为0.1NA | |
| D. | 工业上将氨气与氧气在催化剂作用下发生氧化反应,若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数NA可表示为:$\frac{22.4n}{5V}$ |
5.下列物质在室温下均是分子晶体的是( )
| A. | H2O、CH4、HF | B. | 红磷、硫、碘 | ||
| C. | CO2、SO2、NO2 | D. | H2SO4、CH3CH2OH、HCHO |
9.下列反应的离子方程式书写正确的是( )
| A. | 氯气和水的反应:C12+H2O═2H++Clˉ+ClOˉ | |
| B. | 向Al2(SO4)2溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 硫酸氢铵溶液中加入过量氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| D. | 铜片加入稀硝酸中:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
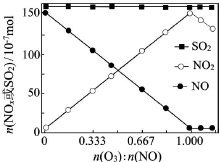 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:

