题目内容
7. 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ•mol-1
NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ•mol-1
SO2(g)+O3(g)═SO3(g)+O2(g)△H=-241.6kJ•mol-1
(1)反应3NO(g)+O3(g)═3NO2(g)的△H=-317.3mol•L-1.
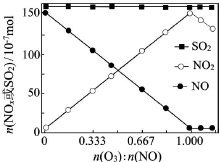
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见下图.
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是O3将NO2氧化为更高价态氮氧化物.
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是SO2与O3的反应速率慢.
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO32-将NO2转化为NO2-,其离子方程式为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O.
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=$\frac{{K}_{sp}(CaS{O}_{3})}{{K}_{sp}(CaS{O}_{4})}×c(S{{O}_{4}}^{2-})$[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率.
分析 (1)①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ.mol-1
②NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ.mol-1
根据盖斯定律,2×②+①可得:3NO(g)+O3(g)=3NO2(g),焓变进行相应的计算;
(2)①臭氧具有强氧化性,能氧化生成的NO2;
②增加n(O3),O3氧化SO2的反应几乎不受影响,说明浓度对反应速率影响较小,可能是其反应速率较慢;
(3)溶液pH约为8,说明溶液呈碱性,SO32-将NO2转化为NO2-,同时SO32-被氧化生成SO42-,根据反应物和生成物书写离子方程式;
(4)CaSO3水悬浮液中加入Na2SO4溶液,发生反应CaSO3+SO42-=CaSO4+SO32-,溶液中c(Ca2+)=$\frac{{K}_{sp}(CaS{O}_{3})}{c(S{{O}_{3}}^{2-})}$=$\frac{{K}_{sp}(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$;根据CaSO3+SO42-=CaSO4+SO32-知,加入硫酸钠导致亚硫酸根离子浓度增大,浓度越大反应速率越大.
解答 解:(1)①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ.mol-1
②NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ.mol-1
根据盖斯定律,2×②+①可得:3NO(g)+O3(g)=3NO2(g),所以△H=2×(-58.2kJ.mol-1)+(-200.9kJ.mol-1)=-317.3kJ/mol,
故答案为:-317.3;
(2)①当n(O3):n(NO)>1时,臭氧过量,臭氧具有强氧化性,能将反应后NO2氧化为更高价氮氧化物,导致二氧化氮减少,
故答案为:O3将NO2氧化为更高价态氮氧化物;
②增加n(O3),O3氧化SO2的反应几乎不受影响,说明浓度对反应速率影响较小,可能是SO2与O3的反应速率慢,
故答案为:SO2与O3的反应速率慢;
(3)溶液pH约为8,说明溶液呈碱性,SO32-将NO2转化为NO2-,同时SO32-被氧化生成SO42-,根据反应物和生成物书写离子方程式为SO32-+2NO2+2OH-=SO42-+2NO2-+H2O,
故答案为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;
(4)CaSO3水悬浮液中加入Na2SO4溶液,发生反应CaSO3+SO42-=CaSO4+SO32-,溶液中c(Ca2+)=$\frac{{K}_{sp}(CaS{O}_{3})}{c(S{{O}_{3}}^{2-})}$=$\frac{{K}_{sp}(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$,所以c(SO32-)=$\frac{{K}_{sp}(CaS{O}_{3})}{{K}_{sp}(CaS{O}_{4})}×c(S{{O}_{4}}^{2-})$;
根据CaSO3+SO42-=CaSO4+SO32-知,加入硫酸钠导致c(SO32-)增大,浓度越大反应速率越大,所以加快反应速率,提高NO2的吸收速率,
故答案为:$\frac{{K}_{sp}(CaS{O}_{3})}{{K}_{sp}(CaS{O}_{4})}×c(S{{O}_{4}}^{2-})$;CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率.
点评 本题考查了溶度积常数计算、反应速率影响因素、氧化还原反应离子方程式的书写、盖斯定律等知识点,综合性较强,侧重考查学生分析计算能力,难点是(4)题计算,题目难度中等.

| A. | “地沟油”禁止食用,但可以用来制皂 | |
| B. | 安全、合理的使用核能有利于降低碳排放 | |
| C. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| D. | 吸烟不会造成室内PM 2.5污染 |
| A. | 某溶液的pH=7,则该溶液为中性溶液 | |
| B. | 一定温度下,向AgCl饱和溶液中加入少量NaCl固体,Ksp(AgCl)减小 | |
| C. | 常温下,反应X(s)+Y(l)═2Z(g)不能自发,则该反应的△H>0 | |
| D. | 常温下,0.01mol/L的NaOH溶液中由水电离的c(H+)=1.0×10-2mol/L |
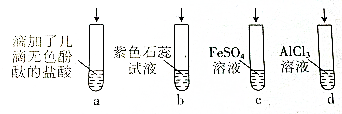
| A. | 若滴加过量的浓氨水,试管a中溶液由无色变红色 | |
| B. | 试管b中溶液由紫色变为蓝色 | |
| C. | 试管c中先有白色沉淀,后变为灰绿色,然后变为红褐色 | |
| D. | 试管d中先有白色沉淀,后白色沉淀消失 |
| A. | 3,3二甲基4乙基戊烷 | B. | 2,5,5三甲基己烷 | ||
| C. | 2,3二甲基丁烯 | D. | 3甲基1戊炔 |
| A. | 能够发生有效碰撞的分子叫做活化分子,活化分子所多出的那部分能量称作活化能 | |
| B. | 对于某一反应aA+bB=cC+dD,△H单位中的mol-1是指每摩尔(aA+bB=cC+dD)反应 | |
| C. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| D. | 甲烷分子具有正四面体结构的原因是碳原子的2S轨道与2P轨道发生SP杂化 |

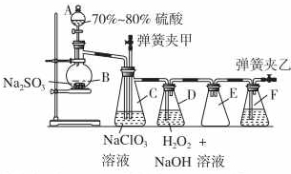 装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)
装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)