题目内容
14.硫及其化合物有广泛应用.(1)硫酸生产过程中涉及以下反应.已知25℃、l0l kPa时:
①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ/mol
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ/mol
则SO2催化氧化为SO3(g)的热化学方程式为2SO2(g)+O2(g)=2SO3(g)△H=-197kJ/mol.
(2)对于SO3催化氧化为SO3的反应.
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况.反应从开始到达到平衡时,用O2表示的平均反应速率为0.0375mol/(L•min).
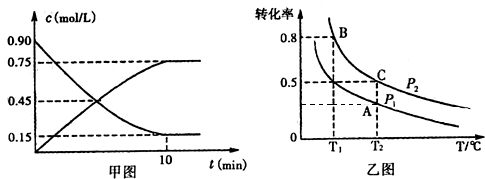
②在一容积可变的密闭容器中充入20mol SO2(g)和l0mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示.则P1与P2的大小关系是P1< P2(填>、=或<);A、B、C三点的平衡常数大小关系为KB>KA=KC(用KA、KB、KC和>、=、<表示),理由是该反应为放热反应,温度升高,平衡常数减小,ABC三点的温度为B<A=C.
(3)工业生成硫酸过程中,通常用氨水吸收尾气.
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为SO2+NH3+H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=CD(填序号).
A.c(SO32-)-c(H2SO3) B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3?H2O)-c(H2SO3) D.c(HSO3-)+2c(SO32-)-c(NH4+)
②已知在25℃时NH3•H2O、H2SO3电离平衡常数如表,则上述所得溶液中各离子浓度由大到小的顺序为c(NH4+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
| NH3•H2O | H2SO3 | ||
| 电离平衡常数(mol/L) | 1.7×10-5 | Ka1 | Ka2 |
| 1.54×10-2 | 1.02×10-7 | ||
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,①-②×2得到;
(2)①图象分析得到三氧化硫浓度变化为0.75mol/L,依据v=$\frac{△c}{△t}$计算三氧化硫的反应速率,反应速率之比等于化学方程式计量数之比得到氧气表示的反应速率;
②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,氧气的转化率增大;平衡常数只受温度影响,与压强无关,正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小;
(3)①同物质的量的SO2与NH3溶于水,发生反应生成亚硫酸氢铵;
根据电荷守恒,可知:c(H+)+c(NH4+)=c(HSO3-)+2c(SO32-)+c(OH-),溶液中氢离子源于水电离、HSO3-的水解、NH4+的水解,氢氧根离子源于水的电离、HSO3-的水解,由水电离得到的c水(H+)与c水(OH-)相等,据此判断;
②HSO3-的水解平衡常数Kh=$\frac{1{0}^{-14}}{1.52×1{0}^{-2}}$=6.5×10-13<Ka2=1.02×10-7,NH4+的水解平衡常数为$\frac{1{0}^{-14}}{1.7×1{0}^{-5}}$=5.9×10-10<Ka2=1.02×10-7,则NH4+的水解程度小于HSO3-的电离,溶液呈酸性,溶液中氢离子源于铵根离子水、HSO3-的电离、水的电离,氢离子浓度大于亚硫酸根浓度.
解答 解:(1)①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ/mol
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ/mol
依据盖斯定律①-②×2得到,SO2催化氧化为SO3(g)的热化学方程式为:2SO2(g)+O2(g)=2SO3(g)△H=-197kJ/mol,
故答案为:2SO2(g)+O2(g)=2SO3(g)△H=-197kJ/mol;
(2)①图象分析得到三氧化硫浓度变化为0.75mol/L,依据v=$\frac{△c}{△t}$计算三氧化硫的反应速率V(SO3)=$\frac{0.75mol/L}{10min}$=0.075mol/L•min,则V(O2)=$\frac{1}{2}$V(SO3)=
0.0375mol/(L•min),故答案为:0.0375mol/(L•min);
②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,氧气的转化率增大,故压强P1<P2;
平衡常数只受温度影响,与压强无关,正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,ABC三点的温度为B<A=C,故平衡常数:KB>KA=KC,
故答案为:<;KB>KA=KC;该反应为放热反应,温度升高,平衡常数减小,ABC三点的温度为B<A=C;
(3)①同物质的量的SO2与NH3溶于水,发生反应生成亚硫酸氢铵,反应离子方程式为:SO2+NH3+H2O=NH4++HSO3-;
根据电荷守恒,可知:c(H+)+c(NH4+)=c(HSO3-)+2c(SO32-)+c(OH-),则c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)
溶液中氢离子源于水电离、HSO3-的水解、NH4+的水解,氢氧根离子源于水的电离、HSO3-的水解,由水电离得到的c水(H+)与c水(OH-)相等,则c(H+)-c(OH-)=[c(SO32-)+c(NH3•H2O)+c水(H+)]-[c(H2SO3)+c水(OH-)]=c(SO32-)+c(NH3•H2O)-c(H2SO3),故CD正确,
故答案为:SO2+NH3+H2O=NH4++HSO3-;CD;
②HSO3-的水解平衡常数Kh=$\frac{1{0}^{-14}}{1.52×1{0}^{-2}}$=6.5×10-13<Ka2=1.02×10-7,NH4+的水解平衡常数为$\frac{1{0}^{-14}}{1.7×1{0}^{-5}}$=5.9×10-10<Ka2=1.02×10-7,则NH4+的水解程度小于HSO3-的电离,溶液呈酸性,溶液中氢离子源于铵根离子水、HSO3-的电离、水的电离,氢离子浓度大于亚硫酸根浓度,各离子浓度由大到小的顺序为:c(NH4+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(NH4+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题考查热化学方程书写、化学平衡计算与影响因素、反应速率计算、化学平衡图象、离子浓度比较、电离平衡常数应用等,是对学生综合能力的考查,(3)中离子浓度大小比较为易错点、难点,关键是判断亚硫酸氢根的水解程度与电离程度相对大小,题目难度中等.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案| A. | NaHCO3比Na2CO3热稳定性差 | |
| B. | NaHCO3比Na2CO3与稀盐酸反应的速度快 | |
| C. | 在相同温度下,Na2CO3的溶解度大于NaHCO3 | |
| D. | Na2CO3能使澄清石灰水变浑浊,而NaHCO3不行 |
| A. | 3,3二甲基4乙基戊烷 | B. | 2,5,5三甲基己烷 | ||
| C. | 2,3二甲基丁烯 | D. | 3甲基1戊炔 |
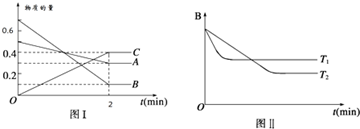
| A. | 2min内A的化学反应速率为0.1 mol/(L•min) | |
| B. | 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动 | |
| C. | 在反应达平衡时,其他条件不变,升高温度,正逆反应速率都增大,且A的转化率增大 | |
| D. | 图(I)中,达平衡时,A的体积分数为37.5% |
| A. | K与F | B. | Na与F | C. | Al与Cl | D. | Mg与Cl |
 今年1月12日,我国3名潜水员圆满完成首次300米饱和潜水作业,实现“下五洋
今年1月12日,我国3名潜水员圆满完成首次300米饱和潜水作业,实现“下五洋 ;如图是贴在某垃圾桶上的标志,该标志的含义是可回收物.
;如图是贴在某垃圾桶上的标志,该标志的含义是可回收物.