题目内容
3.配制480mL0.5mol•L-1的硫酸铜溶液:(1)需用胆矾(CuSO4•5H2O)的质量为62.5g.
(2)在该实验中要用到容量瓶,使用容量瓶的第一步操作是检查是否漏水.
(3)针对此配制过程设计了5个操作步骤:①向盛有胆矾的烧杯中加入20mL水使其溶解;②继续往容量瓶中加水至液面接近刻度线2cm~3cm;③将硫酸铜溶液沿玻璃棒注入500mL容量瓶中;④在烧杯中加入少量的水,小心洗涤2~3次后移入容量瓶中;⑤改用胶头滴管加水至刻度线,加盖摇匀.正确的操作顺序为①③④②⑤.
(4)上述操作中,①③都用到玻璃棒,其作用分别为搅拌、引流
(5)上述操作⑤中,如果不小心加水超过刻度线,采取的补救措施为重新配制..
分析 (1)依据配制溶液体积选择合适规格容量瓶,依据m=CVM计算需要溶质的质量;
(2)容量瓶带有活塞,使用过程 中需要上下颠倒,为防止漏液,使用前应检查是否漏水;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,据此排序;
(4)依据溶解、移液过程中玻璃棒作用解答;
(5)凡是不当操作导致实验失败且无法补救的需要重新配制.
解答 解:(1)配制480mL0.5mol•L-1的硫酸铜溶液,应选择500mL容量瓶,实际配制500mL溶液,需要溶质CuSO4•5H2O的质量为:0.5mol/L×0.5L×250g/mol=62.5g;
故答案为:62.5;
(2)容量瓶带有活塞,使用过程 中需要上下颠倒,为防止漏液,使用前应检查是否漏水;
故答案为:检查是否漏水;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的顺序为:①③④②⑤;
故答案为:①③④②⑤;
(4)溶解时为加快固体溶解速率,应用玻璃棒搅拌;移液时为防止液体洒出,应用玻璃棒引流;
故答案为:搅拌;引流;
(5)上述操作⑤中,如果不小心加水超过刻度线,导致实验失败且无法补救,必须重新配制;
故答案为:重新配制.
点评 本题考查一定物质的量浓度溶液配制过程、物质的量浓度有关计算和误差分析等,明确配制原理是解题关键,注意误差分析的方法,注意容量瓶规格选择及使用方法.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
15.将CH4、CO2催化重整为可用的化学品,对缓解能源危机、改善环境意义重大.
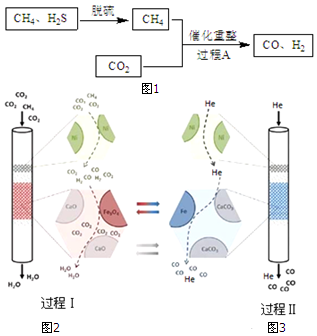
(1)以Fe(OH)3为脱硫剂,通过复分解反应吸收H2S,产物是H2O和Fe2S3.
(2)过程A主要涉及以下反应:
ⅰ.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
①反应ⅰ的化学平衡常数K随温度的变化关系是K随温度升高而增大.
②分析反应ⅱ对反应ⅰ中CO2转化率可能的影响并说明理由:消耗CO、反应放热,都能使反应ⅰ的平衡正向移动,提高CO2的转化率;生成CO2使反应ⅰ的平衡正向移动,但降低CO2的转化率;生成H2使反应ⅰ的平衡逆向移动,降低CO2的转化率(写出一种即可).
(3)某科研团队利用Ni、CaO、Fe3O4三种催化剂在850℃下“超干重整”CH4和CO2:过程Ⅰ.通入CO2和
CH4,所得CO 被吸收,H2O被分离出体系,如图2所示.过程Ⅱ.H2O被分离后,向该装置中再通入He气,使催化剂再生并获得CO,如图3所示.
①CH4和CO2 重整为CO、H2O的热化学方程式是3CO2(g)+CH4(g)?4CO(g)+2H2O(g)△H2=+329kJ•mol-1.
②结合反应方程式简述Fe3O4的催化作用过程Ⅰ4CO+Fe3O4?3Fe+4CO2,4H2+Fe3O4?3Fe+4H2O,Fe3O4被还原,过程Ⅱ3Fe+4CO2?4CO+Fe3O4,Fe3O4重新生成.
③CaO对Fe3O4是否起到催化作用至关重要,实验研究结果如表:
运用有关化学原理解释实验结果:过程Ⅰ中存在平衡4CO+Fe3O4?3Fe+4CO2,添加的CaO与CO2结合成CaCO3,降低了c(CO2),使平衡正向移动,所以有Fe生成,使Fe3O4催化作用更好.

(1)以Fe(OH)3为脱硫剂,通过复分解反应吸收H2S,产物是H2O和Fe2S3.
(2)过程A主要涉及以下反应:
ⅰ.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
①反应ⅰ的化学平衡常数K随温度的变化关系是K随温度升高而增大.
②分析反应ⅱ对反应ⅰ中CO2转化率可能的影响并说明理由:消耗CO、反应放热,都能使反应ⅰ的平衡正向移动,提高CO2的转化率;生成CO2使反应ⅰ的平衡正向移动,但降低CO2的转化率;生成H2使反应ⅰ的平衡逆向移动,降低CO2的转化率(写出一种即可).
(3)某科研团队利用Ni、CaO、Fe3O4三种催化剂在850℃下“超干重整”CH4和CO2:过程Ⅰ.通入CO2和
CH4,所得CO 被吸收,H2O被分离出体系,如图2所示.过程Ⅱ.H2O被分离后,向该装置中再通入He气,使催化剂再生并获得CO,如图3所示.
①CH4和CO2 重整为CO、H2O的热化学方程式是3CO2(g)+CH4(g)?4CO(g)+2H2O(g)△H2=+329kJ•mol-1.
②结合反应方程式简述Fe3O4的催化作用过程Ⅰ4CO+Fe3O4?3Fe+4CO2,4H2+Fe3O4?3Fe+4H2O,Fe3O4被还原,过程Ⅱ3Fe+4CO2?4CO+Fe3O4,Fe3O4重新生成.
③CaO对Fe3O4是否起到催化作用至关重要,实验研究结果如表:
| 编号 | 催化剂 | 是否添加CaO | 还原产物 |
| 1 | Fe3O4 | 添加 | 有Fe |
| 2 | Fe3O4 | 不添加 | 无Fe |
16.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应小于0.1NA | |
| B. | 1molSO2与足量O2在一定条件下反应生成SO2,共转移2NA个电子 | |
| C. | 2.1gDTO中所含中子数为NA | |
| D. | 常温常压下,28gC2H4、CO的混合气体中含有碳原子的数目为1.5NA |
11.下列关于1mol•L-1硫酸溶液的说法中正确的是( )
| A. | 1L水中含有1molH2SO4 | |
| B. | 1L溶液中含有1molH+ | |
| C. | 将98gH2SO4溶于1L水中配成上述溶液 | |
| D. | 1L硫酸溶液中含有96gSO42- |
8.氮氧化合物对环境的损害作用极大.下列环境问题中氮氧化合物不是“重要成员”的是( )
| A. | 酸雨 | B. | 光化学烟雾 | C. | 臭氧空洞 | D. | 温室效应 |
15.下列叙述正确的是( )
| A. | 化学键存在于原子之间,也存在于分子之间 | |
| B. | 离子键是阴、阳离子之间的吸引力 | |
| C. | 离子化合物可以含共价键 | |
| D. | 分子间作用力越大,分子越稳定 |
12. 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:
I、700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
(1)该反应的平衡常数表达式为$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$; 反应在0-t1 min内的平均速率为v(H2)=$\frac{0.3}{{t}_{1}}$mol/(L.min)
(2)保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.3mol/L
(3)判断该反应是否达到平衡的依据为cd(填正确选项前的字母):
a.压强不随时间改变 b.密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和CO2的物质的量相等
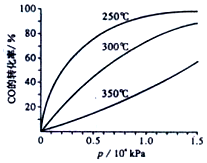
II、CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g)
CO在不同温度下平衡转化率与压强的关系如图所示,该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强而不选择更高压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低
III、某温度下,将1mol CO和1mol H2O(g)充入某固定容积的反应容器中,一段时间后达到平衡:
CO(g)+H2O(g)?CO2(g)+H2(g),此时有$\frac{2}{3}$的CO转化为CO2.
(1)达平衡时H2O(g)的转化率是66.7%
(2)相同条件下,开始时向容器中充入1mol CO2、1mol H2、1mol H2O和0.2mol CO,则开始时的速率
v(正)<v(逆)(填“>”、“<”或“=”)
 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:I、700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
| 反应时间/min | n[CO(g)]mol | n[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | 0.3 |
(2)保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.3mol/L
(3)判断该反应是否达到平衡的依据为cd(填正确选项前的字母):
a.压强不随时间改变 b.密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和CO2的物质的量相等
II、CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g)
CO在不同温度下平衡转化率与压强的关系如图所示,该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强而不选择更高压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低
III、某温度下,将1mol CO和1mol H2O(g)充入某固定容积的反应容器中,一段时间后达到平衡:
CO(g)+H2O(g)?CO2(g)+H2(g),此时有$\frac{2}{3}$的CO转化为CO2.
(1)达平衡时H2O(g)的转化率是66.7%
(2)相同条件下,开始时向容器中充入1mol CO2、1mol H2、1mol H2O和0.2mol CO,则开始时的速率
v(正)<v(逆)(填“>”、“<”或“=”)
13.下列离子方程式正确的是( )
| A. | 向AgNO3溶液中加入Cu粉:Cu+2Ag+═Cu2++2Ag | |
| B. | 向CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| C. | 饱和FeCl3溶液滴入沸水中制Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ |