题目内容
6. M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:(1)R基态原子的电子排布式是1s22s22p63s1,X和Y中电负性较大的是Cl(填元素符号).
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是H2O分子能形成氢键,而H2S不能形成氢键.
(3)X与M形成的XM3分子的空间构型是平面三角形.
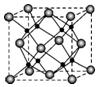
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中大球代表的离子是O2-(填离子符号).
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2↑+7H2O+K2SO4
(6)若晶胞的棱长为a cm,则R2M晶体的密度为=$\frac{248}{{{N}_{A}×a}^{3}}$g•cm-3.
分析 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,核外电子排布式为1s22s22p4,故M为O元素;由原子序数可知R、X、Y均处于第三周期,R是同周期元素中最活泼的金属元素,则R为Na;X和M形成的一种化合物是引起酸雨的主要大气污染物,则X为S元素,可知Y为Cl;Z的基态原子4s和3d轨道半充满,外围电子排布式为3d54s1,处于VIB族,故Z为Cr,由此分析解答.
解答 解:M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,核外电子排布式为1s22s22p4,故M为O元素;由原子序数可知R、X、Y均处于第三周期,R是同周期元素中最活泼的金属元素,则R为Na;X和M形成的一种化合物是引起酸雨的主要大气污染物,则X为S元素,可知Y为Cl;Z的基态原子4s和3d轨道半充满,外围电子排布式为3d54s1,处于VIB族,故Z为Cr.
(1)R为Na,基态原子的电子排布式是1s22s22p63s1,同周期自左而右电负性增大,故Cl元素电负性大于S的,
故答案为:1s22s22p63s1;Cl;
(2)H2O分子能形成氢键,使水的沸点升高,而H2S不能形成氢键,故硫化氢的沸点低于水的,
故答案为:H2O分子能形成氢键,而H2S不能形成氢键;
(3)X与M形成的SO3分子中S原子孤电子对数=$\frac{6-2×3}{2}$=0,价层电子对数为3+0=3,故其空间构型为平面三角形,
故答案为:平面三角形;
(4)M和R所形成的一种离子化合物为Na2O,晶胞中小球数目为8,大球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,小球与大球数目之比为2:1,故图中大球代表的离子是O2-,
故答案为:O2-;
(5)Z的最高价含氧酸的钾盐(橙色)为K2Cr2O7,与氧元素的氢化物发生氧化还原反应,该氢化物为H2O2,在稀硫酸中,Cr元素被还原为+3价,H2O2被氧化生成氧气,反应方程式为:3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2↑+7H2O+K2SO4,
故答案为:3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2↑+7H2O+K2SO4;
(6)M和R所形成的一种离子化合物为Na2O,晶胞中小球数目为8,大球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,小球与大球数目之比为2:1,故图中大球代表的离子是O2-,
晶胞的质量为4×$\frac{62}{{N}_{A}}$g,该晶体的密度为a g/cm3,若晶胞的棱长为a cm,则晶胞的体积=a3cm3,所以密度为:$\frac{248}{{{N}_{A}×a}^{3}}$g/m3,故答案为:$\frac{248}{{{N}_{A}×a}^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、氢键、空间构型、晶胞计算、氧化还原反应等,注意氢键对物质性质的影响,掌握均摊法进行晶胞有关计算.

| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | HClO═H++ClO- |
| A. | CO2的比例模型: | |
| B. | 甲烷的电子式 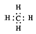 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子构成${\;}_6^{12}$C |
| A. | 工业合成氨时选择500℃ | |
| B. | 配制FeCl3溶液时加入少量的盐酸 | |
| C. | 在Na2CO3溶液中,由水电离出的c(OH-)>1×10-7mol/L | |
| D. | AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2溶液,反应后进行过滤、洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
(1)根据实验1~3判断混合物中一定不存在的离子是Mg2+、Ba2+;
(2)写出实验3中的空格处的实验操作过滤、洗涤;
(3)根据实验对Cl-是否存在的判断是不能确定(填“一定存在”、“一定不存在”或“不能确定”);
(4)溶液中K+是否存在?一定存在(填“一定存在”、“一定不存在”或“不能确定”);若“一定存在”,则K+物质的量浓度的范围>0.1 mol•L-1(若“一定不存在”或“不能确定”不填此空).