题目内容
1.抗酸药作用是:其有效成分都能中和胃里过多的盐酸,缓解胃部不适,其主要成分时能中和盐酸的化学物质,如氢氧化镁、氢氧化铝、碳酸氢钠,写出它们三者分别和盐酸的反应方程式:(1)Mg(OH)2+2H+=Mg2++2H2O;
(2)Al(OH)3+3H+=Al3++3H2O;
(3)HCO3-+H+=CO2↑+H2O.
分析 根据抗酸药物有效成分能中和胃里过多的盐酸分析;
(1)氢氧化镁和盐酸反应生成氯化镁和水;
(2)氢氧化铝和盐酸反应生成氯化铝和水;
(3)碳酸氢钠和盐酸反应生成氯化钠、二氧化碳和水.
解答 解:碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁都能中和胃里过多的盐酸,故答案为:其有效成分都能中和胃里过多的盐酸;
(1)氢氧化镁和盐酸反应生成氯化镁和水,化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式为Mg(OH)2+2H+=Mg2++2H2O,故离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(2)氢氧化铝和盐酸反应生成氯化铝和水,故化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O,离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)碳酸氢钠和盐酸反应生成氯化钠、二氧化碳和水,故化学方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,故离子方程式为:HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O.
点评 本题考查了抗酸药的作用原理和离子方程式的书写,难度不大,应注意的是碳酸氢钠只能拆为碳酸氢根.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
12.硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),SO2的转化率随温度的变化如表所示:
(1)由表中数据判断△H<0(填“>”、“=”或“<”)
(2)能判断该反应是否达到平衡状态的是ACF
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO3的浓度不变 D.C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F.V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol•L-1.
①0~2min之间,O2的反应速率为0.08mol•L-1•min-1.
②此时的温度为600℃.
③此温度下的平衡常数为$\frac{400}{21}$(可用分数表示).
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将正向移动.
| 温度℃ | 450 | 500 | 550 | 600 |
| SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
(2)能判断该反应是否达到平衡状态的是ACF
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO3的浓度不变 D.C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F.V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol•L-1.
①0~2min之间,O2的反应速率为0.08mol•L-1•min-1.
②此时的温度为600℃.
③此温度下的平衡常数为$\frac{400}{21}$(可用分数表示).
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将正向移动.
16.下列行为符合安全要求的是( )
| A. | 进入地下矿井中可用火把照明 | |
| B. | 实验时将水倒入浓硫酸中配置稀硫酸 | |
| C. | 节日期间,在开阔的广场燃放烟花爆竹 | |
| D. | 在实验室可以用手接触药品,用嘴吹灭酒精灯 |
13.某醛8.8克和足量的银氨溶液反应,结果生成43.2克银,则该醛为( )
| A. | 乙醛 | B. | 苯甲醛 | C. | 丙醛 | D. | 丁醛 |

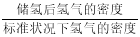 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
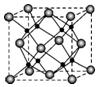 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题: