题目内容
14.下列各电离方程式中,书写正确的是( )| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | HClO═H++ClO- |
分析 分清电解质强弱,强电解质完全电离,应等号,弱电解质部分电离,用可逆号,多元弱酸分步电离,多元弱酸的酸式根离子不能拆,据此解答.
解答 解:A.硫化氢为多元弱酸分步电离以第一步为主,电离方程式:H2S?H++HS-,故A错误;
B.硫酸氢钾为强电解质,完全电离,用等号,电离方程式:KHSO4=K++H++SO42-,故B错误;
C.氢氧化铝为弱电解质,部分电离,用可逆号,电离方程式:Al(OH)3?Al3++3OH-,故C正确;
D.次氯酸为弱电解质,部分电离,用可逆号,电离方程式:HClO?H++ClO-,故D错误;
故选:C.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱是解题关键,注意多元弱酸分步电离,注意电离方程式遵循原子个数、电荷数守恒规律.

练习册系列答案
相关题目
5.甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇.

(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)…Ⅰ.CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.0030 mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0…Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
A.则上表中剩余的实验条件数据:a=150、b=$\frac{1}{3}$.
B.根据反应Ⅱ的特点,图2是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.

(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)…Ⅰ.CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.0030 mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0…Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | a | $\frac{1}{3}$ | 5 |
| 3 | 350 | b | 5 |
B.根据反应Ⅱ的特点,图2是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
3.潜艇中常用的供氧剂是( )
| A. | Na2CO3 | B. | Na2O | C. | Na2O2 | D. | KClO3 |
4.下列有关试验的做法不正确的是( )
| A. | 分液时,分液漏斗的上层液体应由上口到出 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 配置0.1000mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 锥形瓶用作反应容器时可以加热 |

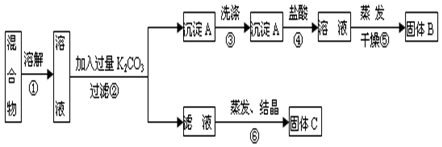
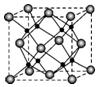 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题: