题目内容
15.Fe2O3又称铁红,请根据要求完成下列问题.(1)铁红加入适量盐酸,反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(2)用上述所得溶液进行下列实验:取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀产生,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓.
(3)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向烧杯中加入几滴饱和FeCl3溶液,继续煮沸至出现红褐色,即可制得Fe(OH)3胶体.在向所得Fe(OH)3胶体中逐滴加入稀硫酸的现象是先产生红褐色沉淀,后又溶解为黄色溶液.
分析 (1)金属氧化物和酸反应生成盐和水;
(2)氯化铁和NaOH发生复分解反应生成红褐色沉淀氢氧化铁;
(3)氢氧化铁胶体呈红褐色;氢氧化铁胶体具有聚沉性质,遇到电解质溶液发生聚沉,氢氧化铁沉淀溶于稀硫酸.
解答 解:(1)氧化铁属于碱性氧化物,和酸反应生成铁盐和水,反应方程式为Fe2O3+6HCl=2FeCl3+3H2O,
故答案为:Fe2O3+6HCl=2FeCl3+3H2O;
(2)氯化铁和NaOH发生复分解反应生成红褐色沉淀氢氧化铁,同时生成NaCl,离子方程式为Fe3++3OH-=Fe(OH)3↓,
故答案为:Fe3++3OH-=Fe(OH)3↓;
(3)将蒸馏水加热至沸腾后,向烧杯中加入几滴FeCl3溶液,继续煮沸至出现红褐色,得到氢氧化铁胶体,在向所得Fe(OH)3胶体中逐滴加入稀硫酸的现象是先产生红褐色沉淀,后又溶解为黄色溶液,
故答案为:红褐;先产生红褐色沉淀,后又溶解为黄色溶液.
点评 本题以铁元素为载体考查化学方程式和离子方程式的书写、胶体的制取和性质等知识点,侧重考查基本理论,知道胶体性质的特殊性,难点是离子方程式的书写,题目难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
5.甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇.

(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)…Ⅰ.CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.0030 mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0…Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
A.则上表中剩余的实验条件数据:a=150、b=$\frac{1}{3}$.
B.根据反应Ⅱ的特点,图2是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.

(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)…Ⅰ.CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.0030 mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0…Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | a | $\frac{1}{3}$ | 5 |
| 3 | 350 | b | 5 |
B.根据反应Ⅱ的特点,图2是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
3.潜艇中常用的供氧剂是( )
| A. | Na2CO3 | B. | Na2O | C. | Na2O2 | D. | KClO3 |
20.如表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si.
(2)画出原子的结构示意图:④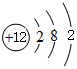 ,⑤
,⑤ .
.
(3)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.(均用元素符号表示)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(均写出物质的化学式)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:④
 ,⑤
,⑤ .
.(3)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.(均用元素符号表示)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(均写出物质的化学式)
7.下列物质不属于氧化物的是( )
| A. | MgO | B. | HClO | C. | Cu2O | D. | ClO2 |
4.下列有关试验的做法不正确的是( )
| A. | 分液时,分液漏斗的上层液体应由上口到出 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 配置0.1000mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 锥形瓶用作反应容器时可以加热 |
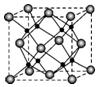 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题: .
.