题目内容
16.下列叙述不正确的是( )| A. | 易溶于水的物质一定是电解质 | |
| B. | 有化学键断裂的变化不一定是化学变化 | |
| C. | 溶解于水所得溶液能导电的物质不一定是电解质 | |
| D. | 水受热不易分解,与水分子之间存在的氢键无关 |
分析 A.电解质水溶液中或熔融状态下导电的化合物;
B.化学变化是旧化学键断裂同时新化学键形成的过程;
C.溶解于水所得溶液能导电的物质可能为电解质或非电解质;
D.水受热不易分解,与化学键有关.
解答 解:A.易溶于水的物质不一定是电解质,也可以为非电解质,如蔗糖、酒精易溶于水为非电解质,故A错误;
B.有化学键断裂的变化不一定是化学变化,如氯化钠溶解过程中有离子键断裂,但无新的化学键形成属于物理变化,故B正确;
C.二氧化硫溶于水导电的原因是二氧化硫与水反应生成了亚硫酸,亚硫酸属于酸,是电解质,二氧化硫是非电解质,溶解于水所得溶液能导电的物质不一定是电解质,故C正确;
D.氢键影响水的熔沸点,不影响水的稳定性,故D正确.
故选A.
点评 本题考查了电解质、非电解质的判断、化合物稳定性的理解应用,熟悉相关概念是解题关键,注意电解质必须是本身能够电离,电解质导电需要条件,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
6.由16个质子、18个中子、18个电子构成的微粒是( )
| A. | 分子 | B. | 原子 | C. | 阴离子 | D. | 阳离子 |
7.在硝酸银、硝酸铜的混合溶液中加入一定量的锌粉,反应停止后,滤液仍为蓝色,有关判断正确的是( )
| A. | 滤渣中一定有银,没有铜和锌 | |
| B. | 滤渣中一定有银和锌,可能有铜 | |
| C. | 滤液中一定有硝酸锌、硝酸铜、硝酸银 | |
| D. | 滤液中一定有硝酸锌、硝酸铜,可能有硝酸银 |
4.下列关于定量测定的说法,错误的是( )
| A. | 发现操作失误,应该重做实验 | |
| B. | 测定结果有偏差,也要记录在实验报告上 | |
| C. | 误差分析后,可更改数据 | |
| D. | 实验报告不能预先完全做好 |
11. 向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
 向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )| A. | 0.25mol/L | B. | 2mol/L | C. | 1mol/L | D. | 0.5 mol/L |
1.某同学在实验室进行以下实验,请将实验①②③的现象和离子反应方程式填入实验报告中.
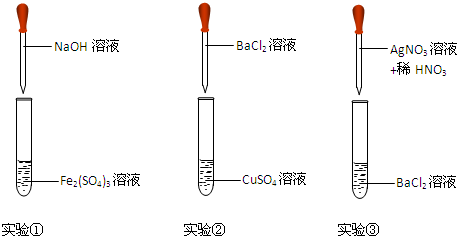

| 编号 | 现象 | 离子方程式 |
| ① | ||
| ② | ||
| ③ |
8.“部分酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,下表是截取溶解性表中的一部分,有关①处物质的说法不正确的是( )
| 阴离子 阳离子 | OH- | Cl- |
| … | … | … |
| Fe2+ | 不 | ① |
| … | … | … |
| A. | ①处物质的化学式是FeCl2 | B. | ①处物质的名称是氯化铁 | ||
| C. | ①处物质可溶于水 | D. | ①处物质类别属于盐 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,则NA个N2分子与足量氢气充分反应释放热量92.4kJ | |
| D. | Na2O2与CO2反应生成1 molO2时,转移的电子数为2NA |
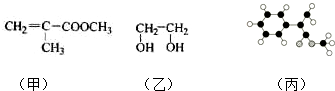

 ;
;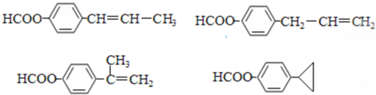 (只写一种即可)
(只写一种即可)